针对原有生产上存在过程繁琐,收率不高等缺点,以5-氯-8羟基喹啉和氯乙酸-1-甲基己基酯为起始原料,研究了解草酯的合成工艺条件,确定了反应所用的碱、反应时间以及加入的5-氯-8-羟基喹啉与氯乙酸-1-甲基己基酯和碳酸钾与氯乙酸-1-甲基己基酯的摩尔比。在解草酯合成工艺条件的基础上,进一步探讨了解草酯合成的反应动力学,确定该反应符合二级反应条件,得到了323、328、333和339 K不同温度下的反应动力学方程式- r2=-
In order to increase the yield and optimize the process of preparation for cloquintocet-mexyl in industrial, the synthesis of cloquintocet-mexyl in this paper was investigated using 5-chloro-8-hydroxyquinoline and methylhexyl chloroacetate as raw materials. The alkali used in the reaction, reaction time, the molar ratio of 5-chloro-8-hydroxyquinoline to methylhexyl chloroacetate and the molar ratio of potassium carbonate to methylhexyl chloroacetate were determinated. The kinetic equation for this reaction was established. The result shows that the synthesis of cloquintocet-mexyl is a second-order reaction. The kinetics experiments were carried out at 323 K, 328 K, 333 K, 339 K, respectively. The frequency factor is 49.82 kJ/mol and the activation energy is 49.82 kJ/mol which are obtained from the reaction rate constants at different temperatures by using the Arrhenius equation. The reaction kinetic equation is - r2=-
小麦是世界三大粮食作物之一,总产量排名第二[1]。 小麦田里生长着各种杂草,通常使用除草剂防治。 炔草酯是其中广泛使用的用于防治小麦田鼠尾看麦娘、燕麦草、黑麦草等的芳氧苯氧丙酸类除草剂,是由瑞士先正达作物保护有限公司开发的[2]。
为了防止除草剂在使用过程中对作物的伤害,通常除草剂和除草剂安全剂(Herbicide Safener)共同复配使用,可以有选择地保护作物不受除草剂的伤害而不影响除草剂对靶标杂草活性。除草剂安全剂有很多品种[3,4,5]。 其中解草酯是一种喹啉类安全剂,又名为解毒喹,其化学名称为1-甲基己基-(5-氯-8-羟基喹啉氧基)乙酸酯,是除草剂炔草酯专用的除草剂安全剂,保护作物不受除草剂炔草酯的侵害,实际使用中二者配比为4∶1[6]。
文献上报道的解毒喹的合成方法有以5-氯-8-羟基喹啉(以下简称:CHQ)为原料,与氯乙酸酯(甲酯或乙酯)反应生成5-氯-8-羟基喹啉乙酸酯皂化,酸解得到5-氯-8-羟基喹啉乙酸,再和异庚醇反应得到目标产物[7,8],或者由5-氯-8-羟基喹啉与氯乙酸-1-甲基己基酯(以下简称:MHCA)反应直接得到解草酯[9]。 但文献报道的操作过程繁琐,收率不高,不适合工业化生产。 本文从工业化角度出发,探讨了适合工业化生产的解草酯的制备方法。
CHQ,含量>99%(湖北威得利化学科技有限公司);MHCA,含量>99%(江苏省东台市金福泰生物科技有限公司);碳酸钾,分析纯(上海凌峰化学试剂有限公司); N, N-二甲基甲酰胺,分析纯(上海凌峰化学试剂有限公司);石油醚,分析纯(上海凌峰化学试剂有限公司);乙腈,分析纯(上海凌峰化学试剂有限公司)。 STI5000型液相色谱仪(上海禾工科学仪器有限公司);X-4型熔点仪(上海精密科学仪器有限公司);AVANCE500型核磁共振仪器(德国Bruker有限公司);ZX-98型旋转蒸发仪(河南予华仪器有限公司)。
液相色谱条件: V(甲醇)∶ V(水)=78∶22,水相含有0.025 mol/L NaH2PO4,检测波长为210 nm,流速为0.8 mL/min。 准确称取0.011 g(精确到0.0001 g)解草酯,用乙腈定容至50 mL。 精确移取1、2、3、4和5 mL上述溶液,用乙腈稀释到10 mL,每次进样10 μL用液相色谱法获得解草酯的标准曲线方程 y=-49793 +3 .77 ×107 c, R=0.9993。 式中, y为解草酯的峰面积, c为解草酯的摩尔浓度(mol/L)。
在100 mL的三口烧瓶中,依次加入20 mL二甲基甲酰胺(DMF),3.0 g(0.0167 mol)CHQ,3.45 g(0.025 mol)K2CO3,室温下搅拌1 h后,慢慢滴加3.2 g(0.0167 mol)MHCA(用20 mL 60~90 ℃石油醚稀释),控制滴加过程温度不超过25 ℃,约2 h滴加完毕,然后继续搅拌0.5 h后,将反应液升温到回流温度66 ℃,搅拌继续反应3 h,然后改回流为蒸发,除去石油醚。 随着溶液中石油醚的减少,溶液温度逐渐上升。 约过15 min,当溶液温度上升到95 ℃,几乎很少有石油醚蒸出时,将溶液冷却到10 ℃,抽滤除去固体,用5 mL DMF分二次洗涤,称取0.1 g左右含DMF的解草酯溶液,用石油醚定容到50 mL。 依1.2节所述的液相色谱外标法测定解草酯含量,计算反应过程收率,确定最佳反应条件。
CHQ与MHCA反应需要在碱的存在下才能反应生成解草酯,碱首先与CHQ生成CHQ的酚羟基钠盐,然后再与MHCA反应。 所选择的碱有Na2CO3、K2CO3和NaOH等,研究中选择 n(CHQ)∶ n(MHCA)=1.1∶1,反应时间为3 h,具体实验结果如表1所示。 从表1结果可以看出,所选择的5种无机碱中,以K2CO3为碱时反应收率最高,而以NaOH为碱时收率最低,这里NaOH碱性最强,NaHCO3和KHCO3碱性最弱,说明碱性太强或者太弱均不利于反应,故而反应时选择K2CO3最佳。
| 表1 不同碱对反应的影响 Table 1 Effect of alkali on the yield of reaction |
反应时间是影响解草酯收率的重要因素,实验保持 n(CHQ)∶ n(MHCA)=1∶1,以K2CO3为碱,研究不同反应时间对解草酯收率的影响,结果如表2所示。 从表2可以发现,当反应时间达到3 h以后,再延长反应时间,收率上升非常小,基本趋于恒定。 但是延长反应时间会导致最终产品色泽加深,产品质量下降。 因而反应时间取3 h为宜。
| 表2 反应时间对结果的影响 Table 2 Effect of reaction time on the yield of reaction |
CHQ与MHCA摩尔比的不同也是反应影响因素之一。 实验选取二者摩尔比从0.9∶1改变到1.2∶1。 考察其对实验结果的影响,具体如表3所示。 从表3可以看出,当 n(CHQ)∶ n(MHCA)达到1.1∶1后,收率几乎不再上升。 因而选择二者比例1.1∶1。
| 表3 CHQ与MHCA摩尔比对结果的影响 Table 3 Effect of mole ratio of CHQ and MHCA on the yield of reaction |
保持 n(CHQ)∶ n(MHCA)=1.1∶1,反应时间为3 h,考察不同K2CO3与MHCA摩尔比情况下对反应收率的影响,结果如表4所示。 从表4可以看出,必须保持投入的K2CO3相对MHCA过量50%以上,才能保证解草酯的收率。 但加入的K2CO3过多,一方面降低过程经济性,另一方面给生产上操作带来不便,延长了K2CO3固体在生产中与母液分离时间,因而选择K2CO3相对MHCA过量50%即可。
| 表4 K2CO3与MHCA摩尔比的影响 Table 4 Effect of mole ratio of K2CO3 and MHCA on the yield of reaction |
目前,尚未见有关解草酯合成的反应动力学研究的报道。 为进一步指导解草酯的工业生产,本文参考类似文献[10,11],进一步研究了解草酯的反应动力学。
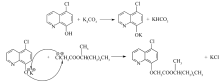
该反应过程如Scheme 1所示。
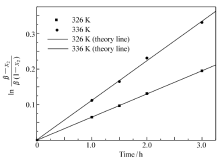
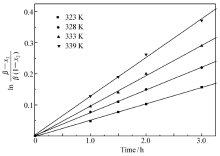 | Scheme 1 Synthesis of cloquintocet-mexyl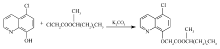 依据反应机理: 依据反应机理:反应第一步为CHQ与K2CO3反应生成CHQ的芳氧基钾盐(以下记为:CHQK),该盐在DMF中有一定溶解度,部分以固体形式存在。 第二步是滴入的MHCA与溶液中CHQK反应,生成产物解草酯和氯化钾。 对参加反应的CHQK和MHCA来说,该反应为二级反应,相应的速率方程如方程(1)或(3)所示。 分别用下标1和下标2分别代表CHQK和MHCA。 取 r2为MHCA表示的反应速度(mol/(L·h)); c2为溶液中MHCA的浓度(mol/L); t为反应时间(h); k为反应速率常数(L/(mol·h)); x2为 t时刻MHCA的转化率。 当MHCA滴加完毕后,若溶液中CHQK和MHCA初始浓度相等,即 c10 =c20时, -r2=- 积分可以得到: 方程(2)表明 实际上,依据反应过程,CHQ首先与K2CO3生成CHQK及KHCO3,溶液中出现大量固体,表明CHQK在室温下只有部分溶解在DMF溶液中。 当MHCA滴加入反应溶液,溶液开始升温以后,溶液中可观察到的固体量明显减少,说明CHQK在DMF中溶解度随温度升高而增大。 推测在某一温度下CHQK已经全部溶解于DMF,由CHQK在DMF中不全溶对反应的影响可以忽略,可以直接采用投入到溶液中CHQ的量计算溶液中实际CHQK的浓度,动力学研究的结果也证明了这一点。 设 -r2=- 积分可得: ln 方程(4)表明,ln 根据上面反应动力学机理进行解草酯的反应动力学实验,实验过程与1.3类似。依据2.1~2.4节的研究结果,选择K2CO3为碱,K2CO3与MHCA的摩尔比为1.5∶1, CHQ与MHCA的摩尔比为1.1∶1。但反应过程改为当MHCA滴加完毕并搅拌0.5h以后,根据需要改变反应溶液的温度分别为323 K(50 ℃)、328 K(55 ℃)、333 K(60 ℃)和339 K(66 ℃),并相应地在每个温度下反应1、1.5、2和3 h以后,5 min内快速蒸发除去石油醚,以减少溶液温度变化对反应结果可能的影响。 然后参考1.3节,将溶液温度降低到10 ℃,抽滤除去固体,用5 mL DMF洗涤固体后,用液相色谱分析溶液中解草酯的含量,计算MHCA的反应转化率,ln 图1的纵坐标为ln ln |
| 表5 不同温度下的反应速率常数 Table 5 The kinetic constants in different temperatures |
表5中, y=ln
反应速率常数 k随着温度变化符合Arrhenius方程:
k=A
方程(5)中 A为频率因子(L/(mol·h)), Ea为反应活化能(J/mol), R为气体常数(J/(mol·K)),方程(5)两边分别取对数可以得到:
lm k=-
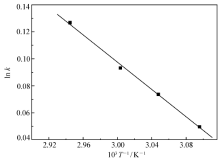
利用表5中的数据, 以ln k为纵坐标,1/ T为横坐标作图,可以得到一条斜率为- Ea/ R,截距为ln A的直线,如图2所示,4个不同温度下的实验点符合方程(6),呈良好的线性关系。
由图2得到MHCA反应活化能 Ea值 Ea=49.82 kJ/mol,频率因子 A=1.46×108 L/(mol·h),相应的解草酯的反应动力学方程为:
-r2=-
研究了以5-氯-8-羟基喹啉和氯乙酸甲基己基酯为原料直接合成解草酯的工艺条件,考察了碱、反应时间、5-氯-8-羟基喹啉和氯乙酸甲基己基酯的摩尔比及K2CO3和氯乙酸甲基己基酯的摩尔比对解草酯收率的影响。 同时探讨了该解草酯合成反应的反应动力学,该反应符合二级反应,计算所得的反应的活化能、频率因子分别为49.82 kJ/mol和1.46×108,所得动力学方程经实验验证准确,研究结果可为工业生产提供理论指导。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|