以三氟乙酰乙酸乙酯、磺酰氯、水合肼、异硫氰酸苯酯、碘代芳烃、氯乙酸等为原料,设计、合成了7种新型的含噻唑环、硫醚和三氟甲基的1,2,4-三氮唑类化合物,通过1H NMR、13C NMR、19F NMR和MS等技术手段对新化合物进行了结构表征。 杀菌活性测试表明,化合物6b、6d和6g在浓度为100 mg/L时对纹枯病菌( Rhizoctoniasolani)的抑制率分别为91%、92%和93%。
Seven novel 1,2,4-triazole derivatives containing thioether and thiazole were designed and synthesized from ethyl 4,4,4-trifluoro-3-oxobutanoate, sulfonyl chloride, hydrazine hydrate, phenyl isothiocyanate, aryl iodides, chloroacetic acid as starting materials via substitution, hydrazinolysis, cyclization and Ullmann coupling. The structures of these compounds were characterized with13C NMR,1H NMR,19F NMR and MS. Bactericidal activity test shows that Rhizoctoniasolani can be inhibited by compounds 6b, 6d, and 6g at a concentration of 100 mg/L with inhibition rates of 91%, 92% and 93%, respectively.
由于作为农药的杂环化合物具有结构变化多样、污染小、高效低毒且具有广泛的生物活性的特点,而备受农药设计者的青睐。 在众多的含氮杂环中,1,2,4-三唑类化合物具有优良的生物活性,在农药领域,已被用作杀虫剂[1]、除草剂[2,3]和杀菌剂[4]等,在医药领域,则被用作抗癌[5]、抗病毒[6]、抗菌[7,8,9]和镇定[10]的药物。 噻唑类化合物也是含氮杂环类化合物的重要组成部分,存在于许多潜在的生物活性分子中,如芬替酸和美洛昔康(两者都是抗炎药),尼扎替丁(抗溃疡剂)和磺胺噻唑(抗菌剂)。 同时,噻唑环也广泛存在于各种天然有机物中,这些天然有机物一般也具有广泛的生物活性,它们具有显著的消炎[11]、抗菌[12]、抗肿瘤[13]、抗惊厥[14]和镇痛[15]等作用。 这使得对噻唑类药物的研究及开发受到化学和药学研究者的广泛关注。 二苯硫醚类化合物也是一类用途广泛的有机化合物,其作为农药中间体在农药合成工业中起着重要作用,目前已经商品化二苯硫醚类农药品种中,杀螨剂有氯杀螨、杀螨硫醚、氟杀螨等,除草剂有pyrithiobac[16]。 研究还表明,二苯硫醚类化合物对真菌也有很强的抑制作用。
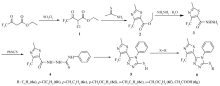
鉴于不同活性的杂环在同一分子中聚集能明显改善其生物活性这一特性[17],本文利用活性亚结构拼接法,将噻唑环、二芳基硫醚、芳基硫乙酸及三氟甲基等活性结构单元引入到三唑类化合物中,设计合成了一系列新型含噻唑环、二芳基硫醚及三氟甲基等结构的1,2,4-三唑类化合物,并初步测定目标化合物的生物活性。 目标化合物的合成路线如Scheme 1 所示。
X-5型双目显微熔点测定仪(北京泰克仪器有限公司),温度计未校正;Mercury Plus-400型核磁共振仪(美国Varian公司),CDCl3或DMSO-d6为溶剂,TMS为内标;AB SCIEX Triple 5600+型液质连用仪(美国AB SCIEX公司); GXZ型智能光照培养箱(宁波江南仪器厂)。 所有试剂纯度均为市售分析纯或化学纯。
2-氯-4,4,4-三氟乙酰乙酸乙酯(化合物1)和2-甲基-4-三氟甲基噻唑-5-甲酸乙酯(化合物2)参照文献[18]方法合成。
2-甲基-4-三氟甲基噻唑-5-甲酰肼(化合物3)的合成:在50 mL圆底烧瓶中加入5.0 g(21.0 mmol)化合物2和3.0 mL(约63.0 mmol)85%水合肼(摩尔比1∶3),静置48 h。 待反应完全后,抽滤,滤饼依次用水、二氯甲烷洗涤,真空干燥得浅黄色固体(化合物3),收率91.0%,熔程为151.4~152.5 ℃;1H NMR(400 MHz,CDCl3), δ:2.71(s,3H,CH3);ESI-MS m/z:226.0313{[M+H]+}。
1-(2'-甲基-4'-三氟甲基噻唑-5'-甲酰基)-4-苯基氨基硫脲(化合物4)的合成:在100 mL的三口烧瓶中加入2.3 g(10.0 mmol)化合物3和40.0 mL无水乙醇,待固体完全溶解后滴入10 mmol苯基异硫氰酸酯,回流3 h,冷却,出现大量白色固体化合物4,抽滤,用少量去离子水洗涤,干燥,得白色固体,收率78%,熔程为140.7~142.3 ℃。1H NMR(DMSO-d6,400 MHz), δ:7.46~7.44(m,2H,Ph—H),7.37~7.33(m,2H,Ph—H);7.18(m,1H,Ph—H);2.75(s,3H,CH3);19F NMR(376 MHz,DMSO-d6), δ:-61.196;ESI-MS m/z:361.0427{[M+H]+}。
5-(2'-甲基-4'-三氟甲基噻唑-5'-基)-4-苯基-4 H-1,2,4-三氮唑-3-硫醇(化合物5)的合成:在50 mL圆底烧瓶中加入3.6 g(10.0 mmol)化合物4和15.0 mL 2 mol/L NaOH溶液,回流4 h,用4 mol/L的盐酸溶液调节pH值至中性,产生大量黄色固体化合物5,过滤,洗涤,干燥,收率64%,熔程189.3~191.2 ℃。1H NMR(DMSO-d6,400 MHz), δ:7.41~7.45(m,2H,Ph—H),7.23(m,2H,Ph—H);7.18(m,1H,Ph—H);2.65(s,3H,CH3);13C NMR(DMSO-d6,100 MHz), δ:171.2,168.7,146.3,141.1(q,2 J=34.8 Hz),134.7,130.2,129.4,128.5,125.8,120.4(q,1 J=270.5 Hz),19.2;19F NMR(DMSO-d6,376 MHz), δ:-60.721;ESI-MS m/z:343.0305{[M+H]+}。
化合物6a~6f的合成:在干燥的安瓿瓶中,加入烘干的搅拌子,在Ar气保护下加入0.5 g化合物5(1.5 mmol)、0.6 g磷酸钾(2.9 mmol)、0.0077 g氯化亚铜(0.073 mmol)、0.0088 g 1,1,1-三羟甲基乙烷(0.073 mmol)、2 mL DMF以及3 mmol碘代芳烃,混合均匀,在Ar气的保护下于100 ℃的油浴中反应24 h。 待反应结束后,将安瓿瓶从油浴中取出,于室温中冷却。 滤除固体,旋转蒸发去除溶剂,经色谱柱分离后得目标产物6a~6g,称重,计算收率。
5-(2'-甲基-4'-三氟甲基噻唑-5'-基)-4-苯基-3-苯硫基-4 H-1,2,4-三氮唑(化合物6a):灰白色固体,产率72%,熔点130.4~131.5 ℃;1H NMR(DMSO-d6,400 MHz), δ:7.46~7.41(m,3H,Ph—H),7.29~7.26(m,2H,Ph—H),7.20(d,2H, J=7.6Hz,Ph—H),7.05~7.01(m,3H,Ph—H),2.72(m,3H,CH3);13C NMR(DMSO-d6,100 MHz), δ:173.2,150.1,146.1,141.1(q,2 J=34.8 Hz),137.8,133.4,131.5,130.9,129.8,129.5,129.0,128.2,125.8,120.2(q,1 J=270 Hz),19.3;19F NMR(DMSO-d6,376 MHz), δ:-60.731; ESI-MS m/z:409.0617{[M+H]+}。
5-(2'-甲基-4'-三氟甲基噻唑-5'-基)-4-苯基-3-(对氯苯硫基)-4 H-1,2,4-三氮唑(化合物6b):棕色固体,产率75 %,熔点146.6~148.9 ℃;1H NMR(DMSO-d6,400 MHz), δ: 7.48~7.43(m,3H,Ph—H),7.30~7.24(m,4H,Ph—H),7.15~7.11(d,2H, J=7.2Hz,Ph—H),2.70(s,3H,CH3);13C NMR(DMSO-d6,100 MHz), δ:173.8,150.1,146.0,141.3(q,2 J=34.8),134.5,131.7,131.0,130.1,129.5,129.1,128.4,128.0,125.4,120.2(q,1 J=270 Hz),19.3;19F NMR(DMSO-d6,376 MHz), δ:-60.728;ESI-MS m/z:453.0221{[M+H]+}。
5-(2'-甲基-4'-三氟甲基噻唑-5'-基)-4-苯基-3-(对甲基苯硫基)-4 H-1,2,4-三氮唑(化合物6c):棕褐色固体,产率51%,熔点 49.1~50.5 ℃;1H NMR(DMSO-d6,400 MHz), δ:7.47~7.43(m,3H,Ph—H),7.26~7.22(m,2H,Ph—H),7.11(d,2H, J=7.6 Hz,Ph—H),6.91(d,2H, J=7.2 Hz,Ph—H),2.71(s,3H,CH3),2.34(s,3H,CH3);13C NMR(DMSO-d6,100 MHz), δ:172.2,150.0,146.1,141.0(q,2 J=34.8 Hz),135.6,134.8,132.9,132.3,131.1,130.4,129.3,128.7,126.1,120.1(q,1 J=270 Hz),24.1,19.3;19F NMR(DMSO-d6,376 MHz), δ:-60.731;ESI-MS m/z:433.0767{[M+H]+}。
5-(2'-甲基-4'-三氟甲基噻唑-5'-基)-4-苯基-3-(对甲氧基苯硫基)-4 H-1,2,4-三氮唑(化合物6d):黄色固体,产率56 %,熔点 83.4~87.8 ℃;1H NMR(DMSO-d6,400 MHz), δ:7.47~7.43(m,3H,Ph—H),7.29~7.27(m,2H,Ph—H),7.06(d,2H, J=8.4 Hz,Ph—H),6.82(d,2H, J=8 Hz,Ph—H),3.73(s,3H,CH3),2.71(s,3H,CH3);13C NMR(DMSO-d6,100 MHz), δ:172.1,164.5,149.8,145.9,141.5(q,2 J=35.0 Hz),133.8,131.0,130.3,129.3,128.8,128.2,125.8,120.7(q,1 J=270.1 Hz),112.1,55.8,19.3;19F NMR(DMSO-d6,376 MHz), δ:-60.729;ESI-MS m/z:449.0619{[M+H]+}。
5-(2'-甲基-4'-三氟甲基噻唑-5'-基)-4-苯基-3-(邻甲基苯硫基)-4 H-1,2,4-三氮唑(化合物6e):黄色固体,产率33 %,熔点 73.8~77.1 ℃;1H NMR(DMSO-d6,400 MHz), δ:7.53~7.48(m,3H,Ph—H),7.29~7.25(m,3H,Ph—H),7.05(d,1H, J=8.0 Hz,Ph—H),6.99(d,1H, J=8.0 Hz,Ph—H),6.91(t,1H, J=7.2 Hz,Ph—H),2.71(s,3H,CH3),2.34(s,3H,CH3);13C NMR(DMSO-d6,100 MHz), δ:173.4,149.9,146.2,143.1,141.9(q,2 J=34.8 Hz),135.7,131.8,130.9,130.1,129.8,129.3,128.5,127.6,126.1,125.1,120.8(q,1 J=270.1 Hz),19.2,16.3;19F NMR(DMSO-d6,376 MHz), δ:-60.731;ESI-MS m/z:433.0767{[M+H]+}。
5-(2'-甲基-4'-三氟甲基噻唑-5'-基)-4-苯基-3-(邻甲氧基苯硫基)-4 H-1,2,4-三氮唑(化合物6f):黄色固体,产率64%,熔点75.3~76.6 ℃;1H NMR(CDCl3,400 MHz), δ:7.46~7.43(m,3H,Ph—H),7.31~7.27(m,3H,Ph—H),7.10(d,1H, J=7.6 Hz,Ph—H),7.01(d,1H, J=8.0 Hz,Ph—H),6.92(t,1H, J=7.2 Hz,Ph—H),3.72(m,3H,CH3),2.68(m,3H,CH3);13C NMR(CDCl3,100 MHz), δ:172.1,156.8,150.2,146.2,142.2(q,2 J=34.8 Hz),132.9,131.0,130.7,129.9,127.6,124.1,121.9,120.4(q,1 J=270.7 Hz),119.5,118.1,112.2,56.4,19.3;19F NMR(DMSO-d6,376 MHz), δ:-60.730;ESI-MS m/z:449.0625{[M+H]+}。
5-(2'-甲基-4'-三氟甲基噻唑-5'-基)-4-苯基-4 H-1,2,4-三氮唑-3-巯基乙酸(化合物6g)的合成:在50 mL的三口烧瓶中加入0.2146 g氯乙酸,加2 mL水使其溶解,缓慢滴加饱和碳酸钠溶液至pH值弱碱性,加入0.5 g化合物5,向三口烧瓶中缓慢滴加35%的氢氧化钠溶液至pH值为12,沸水浴加热,反应途中滴加氢氧化钠溶液使其保持pH值为12,反应结束后,用浓盐酸调节pH值至3~4,冰水中冷却,有固体析出,抽滤,用冷水洗涤至中性,得白色固体,收率92%,熔程85.6~87.9 ℃;1H NMR(CDCl3,400 MHz), δ:7.56~7.54(m,3H,Ph—H),7.39~7.37(m,2H,Ph—H),4.09(s,2H,CH2),2.68(s,3H,CH3);13C NMR(CDCl3,100 MHz), δ:171.9,169.5,152.9,145.2,142.3,141.9(q,2 J=34.8 Hz),132.5,130.4,127.5,124.1,120.6(q,1 J=270.9 Hz),34.8,19.2;19F NMR(DMSO-d6,376 MHz), δ:-60.724; ESI-MS m/z:399.0191{[M-H]-}。
采用离体平皿法对所合成的目标化合物进行了杀菌活性试验。 试验菌体为灰葡萄孢菌( Botrytis cinerea)、小麦赤霉病( Fusarium graminearum)和纹枯病( Rhizoctonia solani)3种菌体,测试质量浓度为100 mg/L。 采用菌体生长速率测定法,将供试药剂在无菌条件下以DMF为溶剂、吐温-80为乳化剂的条件下溶解,并用纯水稀释成1000 mg/L,然后各吸取1 mL药液注入培养皿内,再分别加入9 mL 培养基,摇匀后制成100 mg/L含药平板,以添加含DMF和吐温-80的1 mL灭菌水的平板做空白对照。 用直径4 mm的打孔器沿菌丝外缘切取菌盘,移至含药平板上,处理重复3次。 将培养皿放在(25±1) ℃恒温培养箱内培养。 72 h后调查各处理菌盘扩展直径,求平均值,与空白对照比较计算相对抑菌率。 相对抑制率/%=((对照组菌盘扩展平均直径-处理组菌盘扩展平均直径)/对照组菌盘扩展平均直径)´100。
在目标化合物的合成中,探讨了不同的反应条件对化合物3收率的影响。 最初选用乙醇为溶剂,加热回流6 h,化合物3的收率几乎为0%;接着以乙醇作溶剂,常温静置反应48 h,化合物3的收率为68%;最后在无溶剂的条件下,常温静置反应48 h,化合物3的收率为91%,较前面两种方法,该方法的收率有了较大的提高。 由此可以看出,在无溶剂条件下,常温静置,反应48 h,是合成化合物3的较佳方法。 此外,根据文献[19]还探讨了不同的反应条件对化合物6a收率的影响。 利用Ullmann反应由化合物5合成化合物6。 首先在5%CuCl为催化剂、DMF为溶剂、Ar气氛条件下,比较了不同配体对反应的影响,实验结果显示在以1,1,1-三羟甲基乙烷为配体时,反应进行24 h后,获得44%的收率,其催化效果高于8-羟基喹啉和六次甲基四胺;比较了不同铜盐对反应产率的影响,以CuI为催化剂的时候,获得了68%的收率,CuI的催化效能高于CuCl、Cu2O。 最后,采用该方法成功地合成了其它的目标化合物。
分别以目标化合物6f和6g的1H NMR、13C NMR和H RMS数据为例进行说明。 对于化合物6f,氢谱化学位移在 δ 7.48~6.92之间的吸收峰是苯环上的9个H,化学位移在 δ 3.72处的单峰是甲氧基上的3个H,化学位移在 δ 2.68处的单峰是噻唑环上甲基上的3个H;碳谱化学位移在 δ 56.4处的峰是甲氧基中的碳原子,化学位移在 δ 19.3处的峰是噻唑环上甲基上的碳。 对于化合物6g,氢谱化学位移在 δ 7.56~7.37之间的吸收峰是苯环上5个H,化学位移在 δ 4.09处的单峰是—CH2—上的氢,化学位移在 δ 2.68处的单峰是噻唑环上甲基的氢;化学位移在 δ 34.8处的峰是亚甲基中的碳原子,化学位移在 δ 19.2处的峰是噻唑环上甲基的碳。
化合物5和6对灰葡萄孢菌( Botrytis cinerea)、小麦赤霉病菌( Fusarium graminearum)和纹枯病菌( Rhizoctonia solani)的抑菌活性被测试,噻呋酰胺(thifluzamide)被用作对照药品,实验结果见表1。 初步的试验结果表明,化合物5和6均具有一定的抑菌活性。 由表1可以看出,化合物6b、6d和6g具有与噻呋酰胺可媲美的对纹枯病菌的抑菌活性,抑制率分别为91%、92%和93%。 而且化合物5和6具有比噻呋酰胺强的对灰葡萄孢菌和小麦赤霉病菌的抑制能力。 值得注意的是当化合物苯环的4-位被Cl原子 (化合物6b)、甲氧基取代(化合物6d)或苯环被乙酸(化合物6g)取代时,化合物具有比其它化合物更强的抑菌活性。
| 表1 目标化合物5和6的抑菌活性 Table 1 Antifungal activity(%) as inhibition rate for the compounds 5 and 6 |
以三氟乙酰乙酸乙酯、磺酰氯、水合肼、异硫氰酸苯酯、碘代芳烃、氯乙酸等为原料,经过氯代反应、环化、酯与肼的交换和Ullmann反应合成了一系列新型含噻唑环、二芳基硫醚或芳硫乙酸的1,2,4-三氮唑类化合物6a~6g。 初步的生测结果表明,化合物5和6具有一定的抑菌活性,其中化合物6b、6d和6g具有可媲美噻呋酰胺对纹枯病菌的抑菌活性,抑制率分别为91%、92%和93%。 进一步的衍生合成及生物活性研究正在进行中。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|