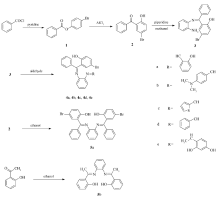
以对溴苯酚和苯甲酰氯为原料,经过酯化、Fries重排、缩合等一系列反应,合成了2-[(2-苯基亚氨基)苯甲基]-4-溴苯酚,该化合物分别与多种醛酮在不同条件下反应,得到了5种不对称双席夫碱和2种对称性双席夫碱。 对席夫碱化合物的抑菌活性测定表明,大部分化合物具有较强的抗菌活性,其中含硫原子的席夫碱抑菌活性最强,最小抑菌浓度均为1×10-4 g/L。
With raw materials of benzoyl chloride and p-bromophenol, mono-Schiff base, 2-[(2-aminophenylimino)phenylmethyl]-4-bromophenol, is obtained through multi-step reactions of esterification, Fries rearrangement and condensation. The mono-Schiff base reacts with aldehydes and ketones to give five asymmetric di-Schiff bases and two symmetric di-Schiff bases. These Schiff bases, particularly those containing sulfur atom in the molecule, show good antibacterial activities with a minimum inhibitory concentration of 1×10-4g/L.
席夫碱(Schiff base)是指含有亚胺基( 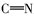
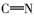
苯甲酰氯、水杨醛、对二甲氨基苯甲醛、2-噻吩甲醛、苯甲醛、邻羟基苯乙酮均为化学纯试剂。
XL-400型核磁共振仪(德国Bruker公司),CDCl3为溶剂,TMS为内标;PE2400型元素分析仪(美国Perkin Elmer公司);AVATAR 370型红外光谱仪(美国Nicolet公司),KBr压片;LCMS-2010A型质谱仪(日本岛津公司);Bruker-D8-Venture型X射线衍射仪(德国Bruker公司);UV-1700型紫外可见分光光度计(北京谱析通用有限责任公司);F-20D型暗箱式紫外分析仪(巩义市子华仪器有限公司);XT4A型显微熔点测熔仪(北京市科仪电光仪器厂);CAM-IIIB智能型抑菌圈自动测定仪(郑州宝晶电子科技有限公司)。
席夫碱的合成路线见Scheme 1。
1.2.1 苯甲酸-4-溴苯酯(1)的合成 参照文献[14]方法,将对溴苯酚17.30 g(0.10 mol)置于250 mL的三口烧瓶中,加入180 mL乙醚将其溶解,机械搅拌至均匀,然后加入吡啶7.91 g(0.10 mol),并迅速称取苯甲酰氯14.06 g(0.10 mol)置于混合溶液中。 搅拌约2 h后,TLC检测已反应完全(展开剂为 V(石油醚)∶ V(乙酸乙酯)=5∶1)。 过滤,滤液用旋转蒸发仪旋蒸,所得白色固体1即为苯甲酸-4-溴苯酯,称重为25.18 g,收率90.9%。
1.2.2 2-羟基-5-溴二苯甲酮(2)的合成 参照文献[14]方法,将500 mL圆底烧瓶放入油浴锅中,加入27.71 g(0.10 mol)化合物1,慢慢升温至120 ℃,待其完全熔化后,油浴加热至150 ℃,分2~3次将无水三氯化铝20.03 g(0.15 mol)加入烧瓶中。 用TLC跟踪至反应完全(展开剂为 V(石油醚)∶ V(乙酸乙酯)=5∶1),约2 h反应完全。 然后将烧瓶置于空气中自然冷却,得暗黄色固体。 向烧瓶中加入适量10%的稀盐酸洗去固体中的三氯化铝,得酮的粗品。 粗品用乙醇重结晶得淡黄色固体产物2,称重21.64 g,收率78.10%。
1.2.3 2-[(2-苯基亚氨基)苯甲基]-4-溴苯酚(3)的合成 参照文献[14]方法,将27.71 g(0.10 mol)化合物2、邻苯二胺10.81 g(0.10 mol)、哌啶9.37 g(0.11 mol)、原甲酸三甲酯12.73 g(0.12 mol) 、150 mL甲醇放入250 mL圆底烧瓶中,加热至回流,反应5 h,旋蒸浓缩50%,冷却,过滤,用热甲醇洗涤滤渣,晾干,得橙红色固体3,收率80.45%。
1.2.4 4-溴-2-{[2-(2-羟基苯基亚氨基)苯基亚氨基]苯甲基}苯酚(4a)的合成 将6.78 g(0.02 mol)化合物3、水杨醛2.44 g(0.02 mol)、哌啶0.18 g(0.02 mol) 、30 mL甲醇置于50 mL的圆底烧瓶中,水浴加热至回流,反应6 h,冷却,过滤,滤渣为黄色粉末,热甲醇洗涤后得产物的纯品4a,收率82.11%,mp 213~214 ℃;元素分析C26H19BrN2O2测定值(计算值)/%:C 66.01(66.25),H 4.12(4.06),Br 17.09(16.96),N 5.86(5.94);1H NMR(300 MHz,CDCl3), δ:14.219(s,1H,OH),12.987(s,1H,OH),8.401(s,1H, 
1.2.5 4-溴-2-{[2-(4-二甲氨基苯基亚氨基)苯基亚氨基]苯甲基}苯酚(4b)的合成 按照合成化合物4a的方法,用6.78 g(0.02 mol)化合物3、对二甲氨基苯甲醛2.74 g(0.02 mol)、30 mL甲醇为原料,得到产物的纯品4b,收率86.35%,mp 191~194 ℃;元素分析C28H24BrN3O测定值(计算值)/%:C 66.99(67.48),H 4.81(4.85),Br 16.21(16.03),N 8.59(8.43);1H NMR(300 MHz,CDCl3), δ:14.772(s,1H,OH),7.993(s,1H, N=CH),6.669-7.688(m,16H,ArH),3.070(s,6H,N—(CH3)2);13C NMR(75 Hz,CDCl3), δ:190.33,174.13,161.90,154.19,140.17,139.30,128.47,128.26,109.74,40.08,40.18(N—(CH3)2),110.95,115.26,118.05,119.91,120.03,121.37,121.81,125.94,126.15,128.06,128.61,129.57,133.42,134.16,135.93(Ar—C)。
1.2.6 4-溴-2-{[2-(2-噻吩基亚氨基)苯基亚氨基]苯甲基}苯酚(4c)的合成 按照合成化合物4a的方法,用6.78 g(0.02 mol)化合物3、哌啶0.18 g(0.02 mol)、噻吩甲醛2.24 g(0.02 mol)和30 mL甲醇为原料,得产物的纯品4c,收率75.13%,mp 125~127 ℃;元素分析C24H17BrN2OS测定值(计算值)/%:C 62.04(62.48),H 3.65(3.71),Br 17.50(17.32),N 6.16(6.07),S 6.84(6.95);1H NMR(300 MHz,CDCl3), δ:14.516(s,1H,OH),8.290(s,1H, N=CH),6.811~7.447(m,15H,ArH);13C NMR(75 Hz,CDCl3), δ:174.28,172.47(N=CH ),161.35(C—OH),128.45,128.38,118.65,119.44,119.55,120.63,122.65,126.12,129.52,131.96,132.85,133.10,133.47,134.09,135.09,136.28,140.64,142.65,143.14(Ar—C)。
1.2.7 4-溴-2-{[2-(苯基亚氨基)苯基亚氨基]苯甲基}苯酚(4d)的合成 按照合成化合物4a的方法,用6.78 g(0.02 mol)化合物3、苯甲醛2.12 g(0.02 mol)、0.50 g冰醋酸和30 mL甲醇为原料,得产物的纯品4d,收率70.96%,mp 105~106 ℃;产物元素分析C26H19BrN2O测定值(计算值)/%:C 68.29(68.58),H 4.16(4.21),Br 17.69(17.55),N 6.22(6.15);1H NMR(300 MHz,CDCl3), δ:14.509(s,1H,OH),8.132(s,1H, N=CH ),6.578-7.395(m,17H,ArH);13C NMR(75 Hz,CDCl3), δ:169.73,161.02,161.13,140.63,137.55,128.04,127.95,116.34,117.69,117.98,118.20,119.76,120.29,122.95,126.79,127.59,128.44,129.27,129.70,131.76,132.28,132.69,133.85,134.56(Ar—C)。
1.2.8 4-溴-2-{[2-(2,4-二羟基苯基亚氨基)苯基亚氨基]苯甲基}苯酚(4e)的合成 按照合成化合物4a的方法,用6.78 g(0.02 mol)化合物3、2,4-二羟基苯乙酮3.04 g(0.02 mol)、对甲苯磺酸0.10 g为原料,得橙黄色固体4e,收率69.91%,mp 126~127 ℃;产物元素分析C27H21BrN2O3测定值(计算值)/%:C 64.40(64.68),H 4.18(4.22),Br 16.05(15.94),N 6.05(5.59);1H NMR(300 MHz,CDCl3), δ:14.036(s,1H,OH),12.398(s,1H,OH),11.495(s,1H,OH),3.234(s,3H,CH3),6.589-7.706(m,15H,ArH);13C NMR(75 Hz,CDCl3), δ:169.95,163.86,162.87,162.04,160.36,141.23,140.49,128.32,127.80,109.69,104.74,39.56(CH3),110.39,116.69,118.05,122.96,123.34,128.79,129.39,129.98,132.06,133.21,133.57,134.26,135.78(Ar—C)。
1.2.9 2-羟基-5-溴二苯甲酮缩邻苯二胺双席夫碱(5a)的合成 取邻苯二胺2.16 g(0.02 mol)、2-羟基-5-溴二苯甲酮55.42 g(0.02 mol)分别溶于适量的无水乙醇中,然后将邻苯二胺的乙醇溶液滴加到装有2-羟基-5-溴二苯甲酮溶液的烧瓶中,水浴加热至回流,反应2 h,冷却,过滤,所得得黄色固体用热乙醇洗涤,得产物的纯品5a,收率71.89%,mp 208~209 ℃;1H NMR(300 MHz,CDCl3), δ:14.021(d, J=5.4 Hz,2H,OH),6.689~7.805(m,30H,ArH);13C NMR(75 Hz,CDCl3), δ:169.07,159.59,142.23,127.3,126.98,107.97,118.54,120.35,122.67,126.83,129.46,132.21,133.04,134.97。
1.2.10 2-羟基-苯乙酮缩邻苯二胺双席夫碱(5b)的合成 按照合成化合物5a的方法,用2.16 g(0.02 mol)的邻苯二胺为原料,得到黄色固体5b,收率76.90%,mp 170~172 ℃;1H NMR(300 MHz,CDCl3), δ:14.004(s,2H,OH),3.297(s,6H,CH3),6.768~7.545(m,18H,ArH);13C NMR(75 Hz,CDCl3), δ:165.85,158.76,139.98,38.17,118.53,119.05,120.57,122.74,129.28,132.64,133.76。
1.3.1 培养基的制备 将蛋白胨(8 g)、牛肉膏(2.4 g)、氯化钠(4 g)、蒸馏水(800 mL)置于烧杯中,放于电炉上边搅拌边加热煮沸,待混合均匀至澄清时,停止加热,趁热加氢氧化钠水溶液调节pH值为7.2~7.4。 将混合液分装到两个250 mL的锥形瓶中(每瓶约装150 mL),剩余的加入7.5~10 g的琼脂,加热至沸腾,趁热倒入两500 mL的锥形瓶中,将瓶口用面塞、纱布和牛皮纸依次封口,待用。
1.3.2 琼脂培养基、培养液的灭菌 将分装后的试管和三角锥瓶放入高压灭菌锅中,排气阀打开的状态下通电加热5~10 min将锅内的冷空气排出后,关闭排气阀,当锅内压力升到0.1 MPa时开始计时,每升到所需压力(0.125 MPa左右,但千万不能超过0.15 MPa),拔掉电源,压力降到0.1 MPa时,插上电源,如此反复15~20 min,自然冷却至压力为零。
1.3.3 平板的制备及菌种培养 灭菌后的物品取出放入超净工作台内(事先开紫外灯杀菌15 min左右),将准备好的琼脂培养基倒入培养皿中均匀铺平,待琼脂培养基凝固后,放入(37±1) ℃的温箱中培养1 d做无杂菌检测;液体培养基冷却后将菌种接入到其中,放到37 ℃的摇床中培养1 d,并活化3次。接种(接二环)到培养液中,放到(37±1) ℃的温箱中,培养16 h,备用。
1.3.4 药片的制备 在慢速定量滤纸上打孔,孔直径为6 mm。 然后将滤纸片放在称量瓶中,放入高压灭菌锅中一同灭菌。灭菌后,将配制好不同浓度的DMSO药液0.1 mL注射到称量瓶中滤纸片上,温箱晾干备用。
1.3.5 接种 在超净工作台中,将活化后的培养液0.2 mL用移液枪移到固体培养基表面,用涂布器涂布均匀,自然冷却后,将灭菌后的药片分散地平铺到其表面,平行3次。将上述放有药片的平板放于(37±1) ℃的温箱中24 h,测量抑菌圈直径。
用红外光谱(IR)对产物进行光谱分析,采用KBr压片,测定在4000-400 cm-1处的红外光谱,其特征数据列于下表1。
| 表1 席夫碱的红外光谱数据(cm-1) Table 1 IR results of Schiff bases(cm-1) |
由表1红外光谱数据可见,化合物2、3、4b~4c在3430 cm-1附近出现了酚羟基的伸缩振动峰,化合物1、2分别在1703和1626 cm-1处出现了C=O伸缩振动吸收峰;目标产物4a~4e均没有发现C=O羰基的伸缩振动吸收峰,同时在1610 cm-1附近出现了 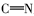
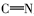
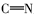
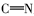
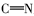
用紫外光谱(UV)对产物进行分析,无水乙醇作溶剂,将产物分别配成约2.0×10-5 mol/L的乙醇溶液,以无水乙醇为参比,用紫外可见光分光光度计分别对产物进行紫外光谱分析,扫描范围为200~400 nm,扫描速度为2 nm/s,其特征吸收峰数据见表2。
| 表2 席夫碱的紫外光谱数据(cm-1/nm) Table 2 UV data of schiff bases(cm-1/nm) |
由表2席夫碱的紫外光谱数据可知,中间产物和目标产物在B带290 nm附近出现较强的吸收带为苯环的π-π*电子跃迁,在R带350 nm附近处出现较弱的吸收带为具有共轭的席夫碱 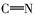
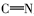
2.3.1 催化剂的影响 与冰醋酸相比,哌啶作催化剂比较温和,所以反应所需的时间比较短。由于合成席夫碱的反应是一个可逆的反应,及时除去产物中生成的水可以缩短反应时间、提高反应产率,这对于哌啶作催化剂的反应非常重要。 与2-噻吩甲醛的反应中,使用哌啶作催化剂并加入原甲酸三甲酯除水时,反应9h还是不完全。 而使用冰醋酸作催化剂时,生成物的熔点较高,在270 ℃左右,且在大部分溶剂中的溶解度较差,怀疑生成了苯并咪唑。
2.3.2 溶剂的影响 在单席夫碱与2,4-二羟基苯乙酮反应时,曾经试图采用无溶剂反应来制备不对称席夫碱,用少量的对甲基苯磺酸作催化剂,油浴加热设定温度为110 ℃,对甲基苯磺酸熔化,与单席夫碱和2,4-二羟基苯乙酮混溶,反应结束时,产物已经完全变为固体,用工业乙醇溶解产物,溶液用旋转蒸发仪蒸馏出乙醇,此时发现产物为深褐色粘稠状物质,难以处理。 在席夫碱与水杨醛反应时,曾试图使用甲苯作溶剂,和正丁醇相比,反应时间与反应速度相似,但甲苯作溶剂未反应的单席夫碱比较多,难以纯化。 使用间二甲苯做溶剂时,油浴加热,反应温度设为80 ℃,在反应数小时后,发现溶液分为两层,上层为深褐色,下层为红褐色粘稠物质,萃取分液,取上,下层溶液点板证明未反应。
根据抑菌圈的大小,可以确定物质的抑菌能力,同时可以得到最小抑菌浓度(MIC),MIC越小,其抑菌活性越强,抑菌圈直径大于20 mm表示具有强抑菌效果,抑菌圈在10~20 mm为中等抑菌,抑菌圈小于10 mm为弱抑菌。 选取上述实验中合成出的5种不对称双席夫碱和2种对称性双席夫碱共7种配体作为供试药剂,按照1.3节的实验方法测定它们对两种供试菌种(革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌)的抑菌圈直径且每种物质在同一浓度下测3次,取平均值。 分别以DMSO作阴性对照,结果显示空白阴性对照DMSO对两种菌种没有抑制作用。 对双席夫碱化合物4a~4e、5a和5b针对大肠杆菌和金黄色葡萄球菌的抑菌活性进行实验考查,抑菌圈大小平均值分别见表3、表4;最低抑菌浓度(MIC)数据列于表5。
| 表3 大肠杆菌抑菌实验结果/抑菌圈平均直径(mm) Table 3 Antibacterial results of the compounds to E.coli/average inhibition zone diameter(mm) |
| 表4 金黄色葡萄球菌抑菌实验结果/抑菌圈平均直径(mm) Table 4 Antibacterial results of the compounds to S.aureus/average inhibition zone diameter(mm) |
| 表5 配体的最低抑菌浓度(g/L) Table 5 MIC of the ligands(g/L) |
分析上述数据,可以看出以下几点:1)不对称双席夫碱对大肠杆菌和金黄色葡萄球菌具有一定的抑菌作用,其中化合物4b、4c、4d的抑菌效果较强;对称性的双席夫碱对两种细菌的抑菌效果很差,但在测定浓度下,抑菌效果均随配体浓度的增大而增强;2)这些席夫碱对革兰氏阴性菌大肠杆菌的抑制作用要弱于对革兰氏阳性菌金黄色葡萄球菌的抑制作用,说明这些席夫碱对细菌的抑制作用具有选择性,但总体来说,选择性并不是很明显;3)对于含有不同取代基的席夫碱来说含硫原子的席夫碱,其抑菌活性最强,水扬醛形成的席夫碱的抑菌活性只有在高浓度时才有抑菌作用;4)当同一取代基处在不同的键位时,它的抗菌活性也不相同,一般为邻位>间位>对位,即空间位阻越小其抗菌活性越强。
以对溴苯酚和苯甲酰氯为原料合成了一种新的单席夫碱,该化合物分别与不同的羰基化合物在酸性催化剂冰醋酸或碱性催化剂哌啶作用下发生缩合反应,合成了5种不对称双席夫碱和2种对称性双席夫碱,并通过UV、IR、13C NMR、1H NMR、元素分析、熔点等测试技术对产物进行了结构表征。 将革兰氏阳性菌金黄色葡萄球菌和革兰氏阴性菌大肠杆菌作为供试菌种测定了化合物的抑菌活性,结果表明,大部分的化合物对金黄色葡萄球菌和大肠杆菌的生长均具有一定的抑制作用并对菌种有一定的选择性,对金黄色葡萄球菌的抑制作用要强于对大肠杆菌的抑制作用,并且大多数不对称双席夫碱的抑菌活性高于对称双席夫碱的,其中含硫原子的席夫碱的抑菌活性最强,对两种供试菌种的最小抑菌浓度均为1×10-4g/L。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|