随着纳米医学的发展,具有控制释放药物和生物活性分子、靶向刺激响应生理环境的聚合物纳米载体成为该领域活跃而具潜力的研究方向。 超支化聚缩水甘油醚因其特定的三维结构、良好的亲水性、生物相容性和可修饰性而引起生物材料界的广泛关注。 而经功能化修饰的超支化聚缩水甘油醚还可自组装成胶束、囊泡等药物载体或共价偶联成大分子前药。 本文从超支化聚缩水甘油醚的疏水两亲修饰、环境敏感性功能化和超分子组装体改性三方面综述了功能化修饰的超支化聚缩水甘油醚在药物载体领域的研究进展。 并系统归纳了超支化聚缩水甘油醚两亲功能化、环境敏感功能化的分子设计策略。 另外,对基于环糊精主客体作用的超支化超分子聚缩水甘油醚共聚物的组装行为进行了简述。
Polymeric nanocarriers with controllable drug realease and stimuli-responsive to targeted biological conditions are an advancing and potential carrier candidate for nanomedicines. Hyperbranched polyglycerols(HPG) spur the interest of the biomaterial community due to their well-defined three-dimensional structures, good solubility, high biocompatiblity and multiple attachment sites for modification. Functionally modified HPG derivatives are able to self-assemble into a variety of drug carriers such as micelles and vesicles. Herein, we present the current progress on functional modified HPG for drug delivery with particular focus on amphiphilic modification, stimuli-responsive functionalization, as well as supramolecular self-assembly. Molecular design strategy for HPG modification with amphiphilic and stimuli responsive functionalization is systematically summarized. Furthermore, the assembly behavior of hyperbranched supramolecular polyglycerol copolymers based on cyclodextrin host-guest interactions is also mentioned.
树形聚合物(Dendritic Polymer)自上世纪80年代被报道以来[1],目前已经成为高分子科学中发展最快的新兴领域。树形聚合物是具有类似树枝状高度支化结构的三维立体构型的高分子。 根据树形聚合物中重复单元的排列特性,可将树形聚合物划分为树枝状聚合物(dendrimer)和超支化聚合物(hyperbranched polymer)两大类。 二者均具有以下特性:大量分子内部空穴结构、末端官能团和相对于线性聚合物的低黏度等。 以上特性使其在大分子自组装、晶体生长调控、纳米封装、药物控制释放等领域具有独特的优势。 二者的区别在于:前者具有规整的支化结构,所有官能团分布于分子外表面,相对分子质量呈单分散性[2];而后者相对分子质量具有一定的多分散性,官能团随机分布于分子内部线性单元和末端单元上[3,4]。 前者在结构上的规整性决定了其在合成过程上的繁琐,需要多步保护、脱保护反应及复杂的、高精度的分离提纯过程,成本很高,因而难以大批量制备。 后者只需一两步反应即可得到[5],效率明显提高。 超支化聚合物与传统线性聚合物相比,由于分子链高度支化、分子具有类似球形的紧凑结构,分子链缠结少,所以具有溶解度高、黏度低、清除慢及体内循环时间长等特点。
超支化聚缩水甘油醚(hyperbranched polyglycerol,HPG)是超支化聚合物中的一个典型代表。它是一种线形单元组成与聚乙二醇(poly(ethylene glycol),PEG)类似, 分子内部为醚键、分子周围具有大量羟基的超支化聚醚[6,7]。 HPG的合成方法主要有阳离子聚合与阴离子聚合两种,但由于阳离子聚合反应过程中容易出现成环副反应,反应产物相对分子质量分布较宽,且得到产物的相对分子质量较小,所以目前首选的合成方法是采用阴离子开环聚合结合单体缓慢滴加技术,即以1,1,1-三羟甲基丙烷(TMP)为核,用甲醇钾对其进行10%去质子化后,引发缩水甘油开环聚合,聚合温度容易控制;TMP经10%去质子化后,使反应过程中存在快速的分子内和分子间的质子转移,加上滴加单体的速度很慢,避免了成环副反应的发生,使产物的相对分子质量分布很窄,且能得到大相对分子质量的聚合物。
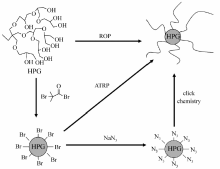
HPG在性能上与PEG一样,具有优异的水溶性和良好的生物相容性,不但在体外的血液相容性、免疫激活和细胞毒性测试[8]中表明无毒性,而且在体内的分布和循环代谢实验中同样表现出良好生物相容性[9]。 另一方面,高相对分子质量的PEG会表现出一定的毒性,而高相对分子质量的HPG依然保持良好的生物安全性[10]。 另外由于具有大量的羟基,可以通过开环聚合(ROP)或者酰氯接枝侧链,将羟基进行修饰,通过原子转移自由基聚合(ATRP)或者点击化学改性来赋予HPG更多的功能(图1)。 基于这些特点,HPG成为了近十年里超支化聚合物研究领域中的明星高分子。
目前,近40%新发现的化学药物是疏水药物[11],为了增大疏水药物的负载并起到缓控释作用,通过两亲性聚合物自组装成的胶束运载疏水药物成为药物载体研究的一个共识。 两亲性的超支化聚合物在水相体系中有别于传统的表面活性剂与线性两亲聚合物,即在较小浓度下两亲性超支化聚合物就可以以单分子胶束的形式存在;随着环境的改变,也可以相互聚集,通过自组装得到宏观螺旋管、巨型囊泡、胶束、多胶束聚集体、纤维和多孔膜等多种组装体[12]。 两亲性超支化聚合物不同层次的自组装行为在国内外已有大量研究开展。
两亲超支化结构往往通过疏水修饰来实现。 而HPG末端具有大量的活性端羟基,可以利用长链酰氯[13]、长链烷基等对其羟基进行疏水改性。 Frey课题组[14,15,16,17]长期从事超支化聚缩水甘油醚的合成与改性研究,运用开环聚合(ROP)得到侧链为环氧丙烷、环氧乙烷、己内酯和脂肪酸的星型均聚接枝聚合物。 这一类两亲性的HPG衍生物在水中往往可自组装成纳米级的胶束,并能够增溶芘[18,19]、尼莫地平[20]和紫杉醇[21]等疏水药物。 Kainthan等采用荧光探针示踪疏水药物[22],发现疏水药物主要位于两亲HPG单分子胶束的“疏水口袋”中。 并且两亲改性的HPG胶束具有良好的生物相容性,体内半衰期长并能排泄出体外,不造成器官内积累[23]。 同时这些两亲结构载体表现出良好的粘膜附着性能,Mugabe等[24]采用疏水改性的HPG纳米载体包埋紫杉醇用于原位膀胱肿瘤的治疗,体内实验表明,具有粘膜附着功能的两亲HPG载体装载紫杉醇后,显示出比标准的聚氧乙烯氢化蓖麻油紫杉醇配方更好的疗效。
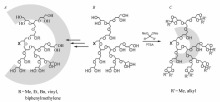
1.1.1 两亲性HPG衍生物分子设计 对HPG进行疏水修饰而得到两亲结构的分子设计方案有多种。 首先是在HPG上直接接枝疏水链,既可以疏水修饰超支化结构的外层,也可以疏水修饰超支化结构的内部(如图2所示)。 从而可调控功能化产物在水相和有机相中的分布系数。其次,在HPG表面修饰两亲结构。 如Kumar等[25]采用区域选择性修饰HPG,在其外围的一级羟基上接枝上羧酸化的PEG,而在二级羟基进行烷基化,最终得到两亲性结构。 该结构可以让疏水性的尼罗红溶解度增大10倍,并在pH=5.0条件下8h释放一半,而在pH=7.4下不释放,并被证明该载体无细胞毒性。 又如李朝兴课题组26-27将具有两亲结构的环糊精分子修饰到HPG上,发现该聚合物在水相中可组装成多分子胶束,并能有效负载紫杉醇和胰岛素,且在体外实验中表现良好细胞相容性和缓释性能。 再次,可选择将HPG作为亲水外壳修饰到疏水的聚合物(特别是树枝状疏水聚合物)上形成两亲性结构。Popeney等[28]采用同步协调的开环超支化聚合,合成了以HPG为壳,超支化聚乙烯为核的两亲超支化共聚物。该共聚物在水相环境中能形成单分子胶束,负载尼罗红后可被细胞内吞而完成输送。
A.hydrophilic shell; B.hyperbranched PG; C.hydrophobic shell
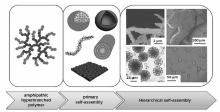
1.1.2 两亲性HPG衍生物的自组装行为 基于不同分子设计策略的两亲性超支化聚缩水甘油醚衍生物在溶剂中能以不同类型的组装形态存在,即可是单分子胶束,也可是多分子组装成的胶束,还可是管状纤维或者双分子层囊泡。 并随浓度、溶剂等因素的变化而分级有序自组装成不同形态(图3),各组装形态会随条件而转换。 如Han等[29]采用点击化学的方法在HPG表面可控修饰不同比例的C16链段和PEG链段,该两亲分子随着溶剂条件的变化而发生分级有序自组装,而呈现不同组装形态(如图4)。
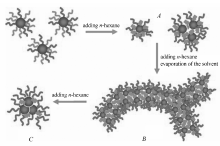 | 图4 HPG-C16-PEG 3个阶段的自组装机制[29] A.unimolecular micelles and micelles formed by a few unimolecular micelles; B.network-like structures made from supramolecular fibres; C.micelles with extending C16 arms and more shrunken PEG armsFig.4 Mechanism for the self-assembly of HPG-C16-PEG in three stages[29] |
以HPG为核进行两亲修饰除自组装成简单核-壳结构的胶束外,还可在HPG核外修饰亲水与疏水嵌段聚合物的多层壳结构[30]。 Haag课题组[31]开发了这种CMS(core-multishell,核-多层壳)结构,以PG为水溶性的核,外层接枝两亲性共聚物,内层壳含长链烷烃,外层壳为亲水性的PEO链。 这种聚合物在水中高于某个临界浓度后,会从单分子自组装成CMS结构(图5 A),不但可用于负载疏水药物,还可运载亲水小分子和蛋白药物。 另外,该课题组又采用简单无毒的方法合成了一种新的CMS结构[32]。 该结构以HPG为核,接枝上修饰了HPG的不同链长的烷烃链,同样形成两亲性的双层壳(图5 B)。 该CMS体系不同于一般纳米载体的地方在于,能形成单分子胶束负载非极性药物,每个共聚物分子能负载1.5个药物分子,但亲水药物的输送则采用多分子聚集体的形式,每个载体可装载10个药物分子。
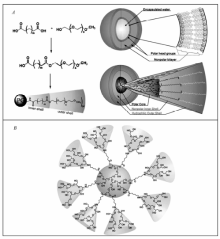 | 图5 具有核-多层壳结构的功能化超枝化聚缩水甘油醚Fig.5 Functional HPG with core multi-shell architectures A.synthesis of CMS architecture and schematic representation of the dendritic multi-shell architecture[31]; B.schematic representation of double-shell architecture with hyperbranched core and highly branched outer shell linked by an alkyl chain of varying lengths[32] |
1.1.3 生物降解型两亲性HPG衍生物 而作为两亲性胶束给药的另一个发展方向是胶束的可降解性。 尽管HPG被证明具有良好的生物相容性,但是经疏水修饰并自组装成胶束后粒子明显增大,在体内的代谢和长期的安全性仍存在隐患。 因此一些可生物降解的HPG载药衍生物被开发出来。 李朝兴等[33]制备了超枝化聚缩水甘油醚/聚乳酸两亲性共聚物,并通过沉淀法制备了纳米粒子,同时考察了该纳米粒子对蛋白药物的包埋和释放性能,发现纳米粒子能释放BSA超过4 d并保持其蛋白活性。 另外,在HPG的合成中引入脂键[34]和缩酮[35]等可降解位点也是一种可选途径。
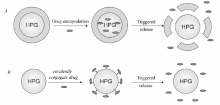
尽管使用两亲HPG胶束可以解决增溶疏水药物和缓控释的问题,但是药物非靶向性扩散的特点使大部分的药物作用于正常的组织,即减小了药物的生物利用度,同时也增加了药物的副作用。 因此制备具有环境敏感型的HPG衍生物是解决药物靶向递送的最优选择,也成为近几十年来广大学者极大关注的领域。 环境敏感型HPG衍生物是一类含有被动靶向性能的药物载体。 其机理为利用病变组织和普通组织间pH值、温度等环境差异而产生一系列结构或性能变化,进而达到靶向治疗病变组织的目的。 而药物在HPG中的负载方式有两种(如图6),一是药物与HPG非共价复合,即物理包埋在HPG衍生物中。 一般具有核壳结构,外壳可对环境响应并裂解,从而靶向突释;二是药物与HPG的键合,即通过化学键将药物固定在HPG上。 形成大分子前药。
1.2.1 共价固定的大分子前药 针对以上两种负载方式,在药物智能响应释放的设计策略上也有所不同。 对于药物-HPG键合的方式(即制备大分子前药),药物分子通过某些可断裂的化学键接到HPG上,这种方式的优点在于能够根据环境刺激精确调控药物的负载与释放。 该化学键既可以在内部因素如pH值、酶浓度和还原剂浓度等的变化下降解,也可以在外部因素如光照、电压和盐浓度等条件下断裂[7]。 Fleige[36]总结了响应上述因素而会发生断裂的各类化学键(图7)。 而用于HPG与药物偶联的常用环境敏感型化学键或分子有:1)脂键,脂键具有pH值与蛋白酶敏感性,易水解。 Kannan团队[37]将布洛芬通过脂键共价结合在HPG上增加细胞的摄取,这种偶联聚合物可以快速将药物递送到细胞内,其消炎作用比单独使用药物更快。 2)肽段,肽段是体内蛋白酶的底物,易被酶解。 Haag课题组[38]设计了阿霉素和甲氨蝶呤分别与Phe-Lys和Ala-Phe-Lys肽段偶联的前药,并以马来酰亚胺封端。 该前药分子能与硫醇化的HPG在温和条件下反应,得到能被组织蛋白酶B水解的大分子前药,并对肿瘤细胞表现出药物活性。 3)腙键和缩醛,这两类化学键具有pH值敏感性,在酸性条件容易断裂。 Calderón等[39]采用腙键偶联阿霉素到HPG上,该前药大分子具有良好的水溶性,酸敏感性,合适的粒径和生理条件下的稳定性。 并在卵巢肿瘤异种移植模型中显示了优于单用安霉素的抗肿瘤功效。 除此以外,近几年又发展了二硫键[40](具氧化还原敏感)和紫罗碱[41](具有光和氧化还原敏感)等智能响应体系用于HPG大分子前药的设计。
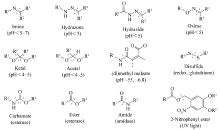 | 图7 刺激响应性纳米载体中的可断裂价键,图中虚线代表被括号中因素刺激而破坏的价键[36]Fig.7 Cleavable linkers used for stimuli-responsive nanocarriersThe dashed line shows the bond that is broken upon activation by the corresponding stimulus which is given in parentheses[36] |
1.2.2 非共价物理包封 药物与HPG共价耦合的前药递送方式,往往在合成上比较复杂,且载药量有限。 因此更多研究集中于药物包埋在HPG衍生物中的方式。 该方式中的HPG衍生物往往具有核壳结构,通过将具有环境敏感性能的单体或聚合物接枝到HPG表面形成纳米载体或微凝胶,而这些功能化的链段能感应外界环境因素的变化来控制药物释放的速率。 按照响应的环境因素不同可以分为pH敏感、温度敏感、光敏感、酶敏感和氧化还原敏感等(如图8)。
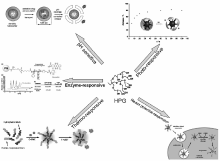 | 图8 不同环境刺激响应类型在功能化HPG药物载体设计中的应用[36,38,42,43]Fig.8 Applications of different stimuli-responsive on functional HPG design for drug delivery[36,38,42,43] |
pH敏感型:依据病变组织与正常组织表现出不同的pH值,以及细胞存在着跨膜pH值梯度变化现象,即细胞中的各种细胞器内的pH值也不同。 开发出具有pH敏感性能的药物载体,使其在不同pH值的生理环境下表现出不同的药物释放速率,从而达到靶向治疗病变细胞和有效降低药物毒副作用的效果。 pH敏感型HPG衍生物被设计成在特定的pH值下会发生一系列的变化,如壳层断裂或者是发生相转变等现象,从而导致药物的靶向释放。 而在HPG衍生物的分子设计上可采用亚胺键、腙键、酰肼键、缩醛、缩酮等对pH值敏感的化学键(如图7)。 Xu等[42]将修饰三段聚乙二醇的苯甲醛接枝到氨基化的HPG上,得到具有核壳结构的pH敏感型HPG衍生物。 其中氨基与苯甲醛反应得到的苯基亚胺基团具有pH敏感性,当周围pH值降低到5.0~6.0之间时,苯基亚胺键会发生断裂,聚醚核便脱去聚乙二醇壳(如图8左上所示)。 Xu将抗癌药物阿霉素和荧光探针包覆进衍生物中,分别在体外和小鼠体内进行药物释放实验,实验结果表明药物释放具有pH敏感性,且具有较理想的药物靶向输送性能。 Sun等[44]通过原子转移自由基聚合将甲基丙烯酸-2-( N, N-二甲氨基)乙酯(DMAEMA)接枝到HPG上。 PDMAEMA 链段上的氨基在不同pH值下发生质子化和去质子化,从而使PDMAEMA部分发生了亲疏水相转变,碱性条件下,HPG- g-PDMAEMA 由双亲水性转变为两亲性, 从而发生胶束化,可负载疏水药物。 Sun等[44]以香豆素102为模型药物,研究了该聚合物在pH刺激响应条件下的药物释放行为, 发现当pH值降低到酸性条件时能快速地释放药物, 但并不能一次性完全释放。 另外,当pH值再升高到强碱性条件时,又能对药物分子进行部分“可逆”的再包载。
温度敏感型:温敏性聚合物作为药物载体用于靶向治疗病变组织,主要利用组织间温差。 一方面人体的不同组织器官天然存在一定的温差,另一方面可以通过现代医疗技术化疗和热辐射疗法使局部病变组织的温度高于其它组织。 温敏聚合物药物载体在特定温度下会发生体积相转变,从而引起溶解状态突变,进而调控包埋在聚合物分子中药物的释放行为。 温度敏感型HPG衍生物通常采用将具有温敏性能的聚合物直接接枝到超支化聚缩水甘油醚表面的方法,常用的温敏聚合物链段有聚 N-异丙基丙烯酰胺(PNIPAM)和聚 N, N-二甲胺基甲基丙烯酸乙酯(PDMAEMA)等。 Kojima等[45]在羧基化的HPG表面接枝上具有温度敏感性能的 N-异丙基丙烯酰胺,从而制得NIPAM-Suc-HPG。该聚合物因为具有温度敏感基团,在温度达到最低临界溶液温度(LCST)时会产生相转变现象,而羧基的存在使得产物可以通过调节pH值来控制相转变温度,进而使得该聚合物具有了pH与温度双重敏感性能。 Taylor等[46]将甲基丙烯酸化的HPG与 N-异丙基丙烯酰胺、甲基丙烯酸羟乙酯化的聚乳酸和丙烯酸进行共聚,得到Poly(NIPAAm- co-HEMAPLA- co-AAc- co-HPG-MA)共聚物,该共聚物兼具温度敏感性、可降解性和良好生物相容性。该聚合物可以通过调节HPG在共聚物中的比例来控制响应温度(LCST),在与子宫肌瘤细胞共培养中表现无毒性,并可在17 h内质量降解92%,被认为适于短时间的靶向药物释放治疗。
光敏感型:伴随着光动力疗法的兴起,采用特定波长光线作为一种外界刺激因素引起聚合物响应释放药物,成为一个有前景的发展方向,因为光的运用简便、生物相容性好且时间和空间上可控[47,48]。 光敏感型HPG衍生物,是通过在超支化聚合物的表面或者内部结构中引入具有光敏感性能的基团来制备获得的。 常见的光敏感基团有两种,一种为邻硝基苄酯,另一种为偶氮苯。 邻硝基苄酯在光照条件下会发生光裂解反应。 偶氮苯基团在可见光照射下处于反式结构,而当暴露在紫外光照射下时( λ=350 nm)其结构会发生光致异构化,从反式结构转变为顺式结构。 Burakowska[43]等在HPG表面引入含邻硝基苄酯单元的交联壳层,该核壳结构的纳米囊具有光敏感性。为了检测纳米囊的光敏释药性能,将放射性玫瑰红钠盐作为模型药物包覆进HPG空腔中,进行体外药物释放实验。实验结果如示意图8(右上)所示,产物在波长为350 nm紫外光的照射下,会因为邻硝基苄酯支链的断裂而脱去外面的壳层结构,从而使超支化聚醚核暴露在溶液环境中,进而导致其内包覆的钠盐逐渐释放到外部环境中。 Han等[49]将炔基修饰的HPG与叠氮修饰的偶氮苯进行点击反应,然后该HPG衍生物与α环糊精通过主客体作用自组装成棒状胶束,该胶束在紫外光的照射下会发生偶氮苯顺反结构异构化而解体,但该体系再置于黑暗中会可逆重新组装成胶束结构。
其它环境敏感型:除了pH值、温度和光敏感三种最典型的环境敏感型HPG衍生物外,氧化还原敏感型也是常用的智能响应因素,以二硫键、半胱氨酸和二茂铁等氧化还原敏感基团为代表。 其中以二硫键最具代表性,其在细胞内外氧化还原电位差异明显(100~1000倍)。 以谷胱甘肽为例,HPG衍生物中的二硫键进入细胞后会被高浓度的谷胱甘肽破坏而造成载体解体(如图8右下),释放出里面的药物或基因,从而起到靶向治疗作用。 Steinhilber等[50]开发了一种用于药物细胞传递,骨架上具有二硫键的聚缩水甘油醚纳米凝胶。 该纳米凝胶微观上呈超支化,宏观上为交联材料。粒径在20~100 nm,负载药物后可被细胞摄取,并通过二硫键在细胞内的断裂使凝胶解体而避免在器官内积累。 该微凝胶在负载吲哚碳菁染料后遇谷胱甘肽降解释放,证明其环境敏感性。
另外,HPG还可以修饰肽段等酶的底物而成为酶敏感型药物载体[51],或者接枝上超顺磁的氧化铁纳米粒子而具有磁响应性[52]。 同时,很多研究人员将不同的刺激响应因素整合,通过共聚或接枝等方法合成具有双响应性或多响应性的功能化HPG药物载体[45,46,53]。 实现了药物释放调控的多元化,提升了载体智能化水平。
有别于传统共价结合的聚合物,超分子聚合物是由可逆的,具有方向性的二级相互作用,即非共价键组织起来的,通过主客体分子的互补匹配形成的聚合序列。 主体和客体分子间空间互补、作用力互补(包括氢键、金属配位效应、疏水作用力、范德华力、π-π共轭和静电相互作用等)。 而这种主客体作用形成的超分子聚合物通常具有可逆性和刺激响应特性[54,55],因此将超分子自组装引入到HPG的功能化改性中,可形成具有智能响应或两亲性的超分子超支化“类嵌段共聚物”。 其主客体分子可逆的自识别偶合和响应环境刺激,为设计HPG衍生物靶向药物载体提供了有效途径。 超分子聚合物中以环糊精(CD)主客体包结络合的方式最为典型。 因为环糊精分子提供很多外围羟基,为可控化学修饰提供了便利。 并且本身为葡萄糖寡聚物,具有优良的生物相容性。 环糊精的疏水空腔也可以通过尺寸匹配、疏水作用来包结络合多种小分子或聚合物官能团,如偶氮苯衍生物分子、mPEG、萘环、金刚烷和二茂铁等。
上海交通大学颜德岳课题组[56]在基于环糊精超分子组装修饰HPG方面做了一系列工作。 Tao等[57]通过阴离子开环的方法,制备出以 β环糊精为核的超支化聚缩水甘油酯(CD- g-HPG),并与金刚烷功能化的长链烷烃,通过主客体作用形成两亲性超支化超分子嵌段共聚物,该嵌段共聚物可在水相中自组装成类脂质体囊泡结构(如图9 A)。 该结构在 β环糊精的竞争结合作用下会解组装。 Liu等[58]在此基础上,制备了具有偶氮苯末端焦点的超支化聚3-乙基-3-羟甲基环氧丁烷(AZO- g-HBPO)。 AZO- g-HBPO和CD- g-HPG 在混合溶剂中进行环糊精-偶氮苯主客体识别组装,得到Janus两亲性超支化-超支化超分子嵌段共聚物。 最终得到类脂质体囊泡结构(如图9 B)。 该超分子囊泡对竞争主客体分子具有超强的稳定性,而紫外光照则可以使这种超分子囊泡解组装。 Liu等又在后续的工作中利用环糊精-二茂铁主客体识别组装成氧化还原响应性超分子聚合物。这类由超分子聚合物自组装成的类脂质体囊泡为药物的靶向递送提供了理想的载体。
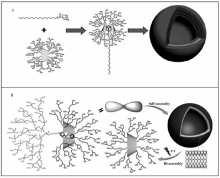 | 图9 功能化HPG超分子自组装[57,59]Fig.9 Supramolecular self-assembly process of functional HPG[57,59] A.supramolecular polymer constructed by CD- g-HPG and adamantane-functionalized long alkyl chain through the host-guest interactions which self-assemble into bilayer vesicles; B.supramolecular polymer constructed by CD- g-HPG and azobenzene-functionalized HBPO through the host-guest interactions which self-assemble into bilayer vesicles |
Adeli等[53]开发了一种具有温度和pH值双敏感的两亲性线性-树枝状超分子体系,可高效负载并递送紫杉醇。 该超分子体系由HPG修饰的 β环糊精( β-CD- g-PG)和具有荧光素末端焦点的PCL双链通过主客体作用形成两亲性超分子聚合物,该超分子树状体在水溶液中能自组装成类脂质体囊泡,并将药物包裹在其中。 并且该体系在温度20~37 ℃和pH值7~8范围内稳定,一旦周围环境超出以上范围,该类脂质体囊泡会发生解组装。 特别是在pH值小于7或大于8时,荧光素与PCL之间的脂键会水解而断裂,造成线性-树枝状超分子体的解体。 但解体出来的 β-CD-g-PG会对释放出来的药物进行二级负载并起缓释作用。
因为超支化聚缩水甘油醚优良水溶性、生物相容性、易可控合成、明确的三维结构并且便于改性等特性,使其成为与聚乙二醇(PEG)相媲美的明星生物医用高分子,特别在大相对分子质量时表现出优于PEG的生物相容性。 从1999年被合成至今,大量研究工作投入到HPG功能化改性分子设计上,使得HPG结构上呈现从超支化聚合物到两亲胶束、类脂质体囊泡、微凝胶和水凝胶各种不同形态。 随着纳米医学和再生医学的发展,这些不同形态的智能和生物相容性材料在其中的药物载体领域被大量应用并发挥优异性能。 HPG既可以通过疏水改性变成两亲性超支化共聚物,自组装成为各类胶束和囊泡类的纳米载体。 也可以在HPG的表面或骨架中引入环境敏感型链段,从而使聚合物载体对体内外的温度、pH值、光辐射、酶等刺激作出智能响应。 还可以通过修饰环糊精等主客体分子来组建超分子聚合物,调控分子结构的可逆自组装。 综合以上技术,赋予HPG高效负载亲疏水小分子药物,生物大分子甚至细胞的能力,并在递送时减少与生物体的非特异作用,实现药物缓控释和智能靶向释放。
而HPG在这里扮演了一个新型的平台角色,通过引入功能化链段,将亲疏水药物的双负载释放、可降解、环境敏感靶向释放、超分子可逆组装和生物相容性等各种元素在这个平台上整合,并根据具体生理环境使用要求,选取以上要素进行组合定制出合适的载体,并要求各要素可调控。 这将是功能化HPG药物载体研究的趋势之一。 具体到发展过程,HPG的功能化经历从简单形成胶束、多层囊泡和微凝胶等物理包埋手段,达到缓释目的,到具备对生理环境的响应性,达到靶向效果,再到这种刺激响应特性可逆化,可精确调控化。 体现了一个载体的分子设计不断满足复杂生理环境的渐进过程,而这一路线预示了药物载体研究前沿方向的变化。
尽管HPG在大量体内外实验中被证明具有优异的生物相容性,但是其功能化衍生物的评价很多止步于体外释放和简单的细胞毒性测试。 而进一步的评价包括血液相容性评价、免疫系统激活、蛋白吸附以及是否能进入代谢而被肾脏清除等需要系统研究。 而且尽管功能化的HPG在体外实验中被证明具有显著的增溶药物和环境刺激响应作用,但一旦进入人体后,大量生理环境下蛋白和多糖等活性物质的参与,是否会对载体的药物增溶产生影响,载体聚合物是否还能发挥其智能响应性或该刺激响应机制在多大程度上有影响,这些都需要系统的体内实验数据加以支撑,并对功能超支化HPG的设计者给予反馈。 另外,随着药物输送载体负载的药物种类的增多,从小分子化药到天然提取物,再到生物活性大分子,均能被负载后递送。所以系统的药物与聚合物载体相互作用研究,将有助于在载体分子设计与提高药物生物利用度方面提供理论支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|