蛋白质与多糖的静电作用是生物体内一个基本医学-化学现象,是实现自组装的主要驱动力,可利用这种非共价作用设计和构筑理想的微结构。 以大豆分离蛋白(Soybean Protein Isolates,SPI)和壳聚糖(Chitosan,CS)为原料,采用浊度法考察了配比、溶液pH值、离子强度和温度对SPI与CS在溶液中相互作用的影响。 结果显示,由于pH值影响静电作用强度,从而成为影响SPI与CS相互作用的主要因素,其中,当pH值为5.5~6.6时,SPI与CS可以实现有效结合。在较低的离子强度下,有利于形成具有紧凑结构的CS/SPI聚集体,较高离子强度下聚集体发生解离。 蛋白质受热发生变性,多肽链上的疏水氨基酸残基暴露在溶液中,导致与壳聚糖链的疏水作用增强。 DLS结果显示,CS与SPI自组装形成了分布均一的纳米粒子,变性后的SPI与CS形成的纳米粒子粒径有所增大,分布均一;经戊二醛交联,粒径有所减小。 SEM显示,壳聚糖单层膜表面存在龟裂现象,与SPI形成双层膜后龟裂消失;同时,单层膜厚度约为300 nm,双层膜厚度约为500 nm。
Electrostatic interactions between proteins and polysaccharides are a fundamental physico-chemical phenomenon in vivo. These interactions are believed to be the main driving force for the self-assembly. In addition, a proper understanding and control of this interaction should enable to design desired structures. Herein, the influences of mass ratios of chitosan(CS) to soybean protein isolates(SPI), pH, ion strength and temperature on the interactions between SPI and CS were investigated. The strength of electrostatic interactions between SPI and CS were mainly influenced by the pH values of solutions. The aggregation of SPI and CS occurred at pH varying from 5.5 to 6.6. At the low ion strength, a compact CS/SPI aggregates was formed, whereas, CS/SPI aggregates are dissociated at higher ion strength. As the heating induced denaturation of SPI, hydrophobic amino acid residues on the peptide chains are exposed to the solution, which results in an increase in hydrophobic interactions between CS and SPI. Furthermore, CS/SPI particles and bilayer film were prepared by adjusting the factors above. DLS reveals that nanoparticles are formed by the self-assembly between CS and SPI, and the hydrodynamic diameter is about 200 nm with uniform distribution. After the denaturation of SPI induced by heating, the hydrodynamic diameter is increased. Cross-linking by glutaraldehyde inducs a little decrease of hydrodynamic diameter. SEM results show that there are some cracks in the surface of chitosan monolayer film with thickness of ca 300 nm, and the cracks disappear after the formation of the bilayer film(CS/SPI) with thickness of ca 500 nm.
蛋白质和多糖是生物体内的两类重要的生物大分子,在生命体系中自然、有序的结合以保持细胞的完整性或细胞分裂,它们之间的相互识别和相互作用在生物化学过程中具有重要的作用[1]。 同时,多糖和蛋白质来源丰富、环境友好、可生物降解、生物相容性好、无毒,研究它们的相互作用,在微型和纳米封装、多层膜的设计、食品乳液的形成和稳定、新的食品凝胶的形成以及从工业副产品中提取蛋白质等领域,具有重要的应用[2]。
大豆分离蛋白(Soybean Protein Isolates,SPI)是典型的球状蛋白,主要含有 β-大豆伴球蛋白(7S球蛋白)和大豆球蛋白(11S球蛋白),它们均由17种氨基酸组成[3,4,5,6]。 SPI是大豆的重要组分,是一种来源丰富的食品蛋白[7]。 通过调节温度、压力等条件会引起SPI的凝胶化[8,9,10,11],也是食品加工过程中常用技术手段。 实质上,SPI的凝胶化,是由于蛋白质变性引起分子间疏水作用和氢键等非共价键弱相互作用自组装的结果[12],这是球状蛋白的基本特征[13]。 多糖的存在会改变蛋白质分子间的组装行为,如果胶[14,15]、阿拉伯胶[16]、卡拉胶[17]与SPI的自组装行为已被报道,静电作用、疏水作用以及氢键等弱相互作用是它们实现自组装的驱动力。 其中,多糖与蛋白质的静电作用是一个基本的医学-化学现象,与许多已知生物学过程有关,如蛋白转录,抗原-抗体反应或酶输送, 也是它们实现自组装的主要驱动力[18,19]。
壳聚糖(Chitosan,CS)是一种天然多糖,是甲壳素的脱乙酰产物,具有无毒、与体液不反应、良好的生物相容性、对细胞有亲合性、可降解性等特点。 壳聚糖能够在生物体中酶解成易被活体吸收、无毒副作用的小分子物质,不会残留在活体内,是一类生物降解吸收型高分子材料[20,21,22]。 壳聚糖骨架具有疏水性,其侧链的氨基在溶液中由于电离而带正电,是典型的阳离子聚电解质。 壳聚糖与生物大分子DNA和蛋白质通过静电作用等非共价键可以形成稳定的复合物,可以作为输送和保护DNA、蛋白质以及多肽等大分子的载体[23,24,25,26]。 壳聚糖与淀粉能够形成共混膜,其薄膜或涂层可用于包衣(即涂料或包装),能够延长食品的保质期,还可与食物一起食用[27,28]。
多糖对大豆蛋白进行修饰主要有共价交联和静电相互作用这两种方式,以共价交联与大豆分离蛋白形成可溶性稳定复合物的多糖主要有葡聚糖[29]和果胶[14,15,30],这种方法制备的多糖/蛋白质复合物可以有效的提高蛋白质的功能性质,如溶解性、乳化性、发泡性和热稳定性[31],但是该方法所需反应条件比较苛刻,往往对反应过程中的温度和相对水分湿度控制比较严格,而且所需时间较长,通常需要几天到几周的时间来完成反应[32,33,34]。 与其它多糖相比,壳聚糖是典型的聚阳离子电解质,可实现与蛋白质的静电作用,从而实现静电自组装。 同时,壳聚糖具有良好的成膜性,为实现壳聚糖/蛋白质复合多层膜的制备提供保证。
本文以壳聚糖(CS)和大豆分离蛋白(SPI)为原料,通过分别调节CS/SPI配比、溶液pH值、离子强度、温度考察它们在溶液中的组装。通过组装过程考察,制备了非变性CS/SPI纳米颗粒(CS/N-SPI)、变性CS/SPI纳米颗粒(CS/DN-SPI)和戊二醛交联的CS/SPI纳米颗粒(Ga-CS/SPI)以及CS/SPI双层膜。 并采用动态激光光散射仪对其粒径分布和Zeta电位进行了测定,同时采用扫描电子显微镜观察了CS/SPI双层膜的表面和断面形态。
壳聚糖(CS):高粘度,脱乙酰度>95%,购于浙江玉环化工有限公司。 大豆分离蛋白(SPI):食品级,购于庞博生物有限公司。 硫酸(98%H2SO4)、过氧化氢(30%H2O2)、氢氧化钠(NaOH)、氯化钠(NaCl)均为分析纯,购于天津凯信化学工业有限公司,使用前未经过纯化处理。
TU-1901型双光束紫外可见光分光光度仪(北京普析通用仪器有限责任公司),在500 nm处测定透光率( T%),采用100- T%表示浊度。 Nano-ZS型多角动态激光光散射仪(英国马尔文仪器有限公司),激光波长为633 nm,散射角度为90°,测试温度25 ℃。 JSM-6701F型扫描电子显微镜(日本电子光学公司)。
移取5 mL浓度为5 g/L SPI溶液,加入一定体积的浓度为2 g/L CS溶液。 调节溶液pH值、混合配比、离子强度以及温度等,室温搅拌1 h,用二次水补充溶液体积至20 mL,即得CS/SPI混合溶液。 测定混合体系浊度。
分别准确移取5 mL浓度为5 g/L的SPI溶液和2.5 mL浓度为2 g/L的CS溶液,均匀搅拌。 分别滴加2 mol/L NaCl溶液和2 mol/L NaOH溶液调节溶液离子强度至20 mmol/L和pH值为5.5,用二次水补充溶液体积至20 mL。 室温搅拌1 h,即得非变性CS/SPI纳米颗粒(CS/N-SPI)。
分别准确移取5 mL浓度为5 g/L的SPI溶液和2.5 mL浓度为2 g/L的CS溶液,均匀搅拌。 分别滴加2 mol/L的NaCl溶液和2 mol/L的NaOH溶液调节溶液离子强度至20 mmol/L和pH值为5.5,用二次水补充溶液体积至20 mL,90 ℃加热搅拌40 min,即得变性CS/SPI纳米颗粒(CS/DN-SPI)。
将98%硫酸与30%过氧化氢以7∶3的体积比混合,将玻璃基片放入混合液中在100 ℃下处理30 min。 然后取出玻璃片用二次水冲洗,室温自然晾干备用。 将预处理的玻璃片置入在2 g/L壳聚糖溶液中浸泡30 min,再用二次水冲洗,室温下自然晾干,即得壳聚糖单层膜。 然后将晾干的玻璃基片置入5 g/L SPI溶液(pH=5.5)中浸泡30 min,取出后用二次水冲洗,自然晾干,即得CS/SPI双层膜。
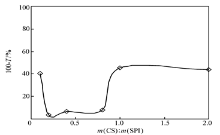
分别配制不同质量比的CS/SPI混合液,总体积不变,且要保证混合液中SPI的浓度一定,调节各CS/SPI混合液的pH值为5.5,测其透光率转化为相应的浊度如图1所示。 在壳聚糖浓度较低时,随着 m(CS)∶ m(SPI)的逐渐增大,混合液的浊度变小,说明壳聚糖与大豆分离蛋白发生了自组装。 原因可能是CS浓度较低时,溶液中主要成分是SPI,形成的CS/SPI可溶性复合物较少,SPI溶液导致体系溶液浊度较大,当 m(CS)/ m(SPI)在0.2以后溶液中的CS与SPI形成一定量CS/SPI可溶性复合物,致使体系溶液浊度开始下降。 随着CS浓度的不断增加,当 m(CS)/ m(SPI)超过0.8以后,CS过量导致体系溶液浊度开始变大。 在壳聚糖与大豆分离蛋白质量比为0.2~0.8之间时,浊度基本保持不变并达到最小值,之后又逐渐增大,当 m(CS)/ m(SPI)=1时到达最大值并不再变化。 由此可以得出, m(CS)/ m(SPI)为0.2~0.8是二者自组装的最佳配比区间。
大豆分离蛋白是多组分球状蛋白,是典型的两性聚电解质,在溶液中发生电离而表面存在大量的电荷;壳聚糖是典型的聚阳离子电解质,在稀酸溶液中被电离而形成表面带正电荷的刚性链[21]。 对于这两种聚电解质而言,表面电荷密度与带电性质除了与其自身的结构因素有关外,溶液pH值是主要影响因素。 与其它多糖和蛋白质的混合溶液一样,在它们的混合溶液中,壳聚糖与大豆分离蛋白存在静电作用、疏水作用、氢键以及范德华力非共价键相互作用,从而引起它们之间的自组装。 其中,静电作用是实现它们自组装的主要驱动力,混合溶液pH值是决定该作用力的主要因素。图2所示是不同质量比的CS/SPI混合体系的浊度随溶液pH值的变化趋势。
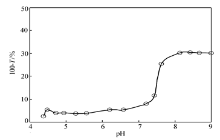 | 图2 pH值对CS/SPI 混合溶液浊度的影响Fig.2 Effect of the pH value on the turbidity of the CS/SPI mixture solutions |
一般认为,线性聚电解质与蛋白质在溶液中的相互作用随着混合体系pH值的变化,会出现如下3个状态:Ⅰ.电解质分子与蛋白质分子尚无作用,Ⅱ.可溶性复合物的形成,Ⅲ.不溶性复合物的相分离[35]。 由图2不难看出,当溶液pH值达到4.5时,浊度突然增大,而后呈现下降趋势。 说明pH值为4.5左右为大豆分离蛋白等电点,与文献[4]报道值(pI为4.8~6.4)较为接近。 在该pH值环境中,SPI的溶解度较小,所以导致溶液浊度增大。 随后,溶液浊度逐渐减小,当pH值达到5.5,溶液浊度逐渐开始增大。 分析认为,在该pH值区间内壳聚糖与SPI尚无明显作用,即状态Ⅰ。 浊度减小是由SPI在溶液中溶解度逐渐增大引起。
随后,在pH值5.5~6.6之间,溶液浊度保持增大趋势,同时增大速度相对缓慢。 此时SPI表面呈负电性,壳聚糖骨架仍为正电性,因此它们之间存在静电吸引作用,形成可溶性自组装体,即状态Ⅱ。 当溶液pH值大于6.6以后,浊度开始明显增大,随着pH值得逐渐增大,浊度增大速度加剧,并且当pH值大于8.0,溶液中出现大量沉淀。 说明当pH值大于6.6,大量CS/SPI不溶性复合物形成,发生相分离,即状态Ⅲ。 同时,壳聚糖在溶液中溶解度的降低也是引起体系浊度增大的主要因素之一。
由此不难得出结论,当pH值在5.5~6.6之间,混合体系中有大量CS/SPI可溶性复合物形成,说明壳聚糖与SPI的静电吸引作用最强,是实现壳聚糖与SPI静电自组装的最佳pH值区间。
离子强度是影响静电作用的另外一个主要因素,盐的加入导致蛋白质表面电荷屏蔽,造成静电作用减弱。 对于线性高分子链,离子强度的增大会使链更加收缩,链更加卷曲,使其刚性减弱,柔性增强[36]。图3为 m(CS)∶ m(SPI)=1∶5,pH=5.5时CS/SPI混合体系的浊度随溶液离子强度变化趋势。 如图3所示,当NaCl浓度小于20 mmol/L时,浊度减小;当NaCl浓度在20~50 mmol/L时,浊度基本保持不变;当NaCl浓度在50~70 mmol/L时,浊度增大;当NaCl浓度大于70 mmol/L时,浊度保持减小趋势。
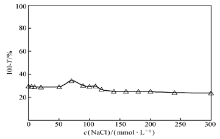 | 图3 离子强度对CS/SPI混合溶液浊度的影响Fig.3 Effect of the ion strength on the turbidity of the CS/SPI mixture solutions |
上述结果说明,在较低离子强度(NaCl浓度在0~20 mmol/L)时,小分子离子的存在屏蔽了壳聚糖主链的电荷,造成线性壳聚糖链柔性增大,对SPI分子的包覆作用增强,有利于CS/SPI聚集体的形成。 而在中等浓度离子强度(NaCl浓度在20~70 mmol/L),由于小分子离子对聚电解质的屏蔽作用,使它们之间的相互作用减弱,聚集体尺寸增大,体系浊度增大。 继续增大离子强度,即NaCl浓度大于70 mmol/L,电荷屏蔽作用更加明显,SPI与壳聚糖的静电吸引作用明显减弱,聚集体发生解聚,浊度明显降低。 因此,不难得出结论,在较低的离子强度下(NaCl浓度小于20 mmol/L),有利于形成具有紧凑结构的CS/SPI聚集体。 高离子强度的环境中,聚电解质之间的相互作用较弱,阻碍了自组装体的形成。
热处理会引起蛋白质的变性,使处在蛋白质分子内部的部分疏水氨基酸残基由于二级结构的变化裸露在外部, 引起疏水作用和氢键作用的增强,也有利于多糖与蛋白质之间的疏水作用增强[12]。 对于SPI来说,在较低温度时,构象变化不明显,当加热温度大于90 ℃时,其构象会发生较大变化[9]。 因此,考察了 m(CS)∶ m(SPI)=1∶5,pH=5.5的CS/SPI混合体系在90 ℃受热时浊度随时间的变化情况。
如图4所示,当CS/SPI混合体系在90 ℃下受热20 min时,CS/SPI混合液浊度增大至最大值;随着受热时间的延长,浊度逐渐减弱,并且受热时间在30~60 min,浊度变化相对平缓。 当混合溶液受热超过60 min时,溶液出现大量沉淀,并随着时间的延长,沉淀量增多。
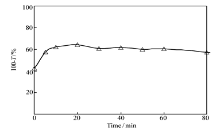 | 图4 90 ℃下加热时间对CS/SPI混合物溶液浊度的影响Fig.4 Effect of the annealing time on the turbidity of the CS/SPI mixture solutions heated at 90 ℃ |
由此说明,混合体系在90 ℃受热初期,主要是由于球状蛋白质逐渐变性,大量疏水基团外露,由于疏水作用增强,形成蛋白质团聚体,导致浊度上升[12];同样,SPI与壳聚糖的疏水作用增强,导致形成CS/SPI聚集体更加紧凑,粒径更大,也会导致体系浊度增大。 当受热时间超过20 min,SPI初期变性基本完成,蛋白质团聚体和CS/SPI聚集体随着搅拌时间的延长逐渐变得更加紧凑,所以出现浊度略微下降趋势,基本保持平缓。 随着受热时间的延长,SPI溶解度会降低[37],导致SPI与壳聚糖的相分离,从而浊度明显增大。
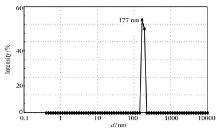
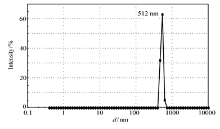
如图5所示,横坐标Size( d/nm)即为纳米颗粒的流体力学直径(Hydrodynamic Diameter,简写为 Dh)。 由图5不难看出,CS/N-SPI粒径分布较窄,最高峰出现在177 nm(图5)。 Zeta电位为(-15.03±3.20) mV(表1),CS/DN-SPI粒径分布较窄,在最高峰512 nm处最为集中,颗粒尺寸较CS/N-SPI纳米颗粒增大(图6),Zeta电位为(19.80±1.47) mV,与CS/N-SPI纳米颗粒表面电荷性质相反,这是由于SPI受热变性所致。
| 表1 CS/SPI 纳米粒子的Zeta电位 a Table 1 Zeta potential of CS/SPI nanoparticles |
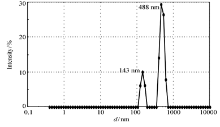
在CS/SPI体系中存在蛋白质分子和壳聚糖链,蛋白质多肽链中的部分氨基酸残基提供的氨基和壳聚糖侧链的氨基可以与戊二醛发生交联。 如图7所示,加入戊二醛后形成的纳米颗粒(Ga-CS/SPI)在143和488 nm出现两个峰,但与CS/DN-SPI相比,尺寸有所减小,说明戊二醛的交联作用使粒子收缩,同时造成交联的不均性。 SPI氨基酸残基中的氨基和壳聚糖侧链的氨基与戊二醛反应,使得它们对纳米颗粒的电荷贡献减小,即Zeta电位减小。
图8为SEM观察到的壳聚糖单层薄膜表面形貌,CS单层膜中出现了大量的不均匀的龟裂现象。 在SPI溶液中浸泡后,形成CS/SPI双层膜,发现龟裂现象消失,且表面较为均匀(图9)。
如图10和图11,采用SEM分别对CS膜和CS/SPI双层膜断面进行观测,CS单层膜厚度约300 nm(图10);CS/SPI双层膜厚度分布均匀,结构致密,无龟裂现象,从图11明显看到清晰的双层结构,厚度约500 nm。 上述结果说明,CS与SPI可以通过非共价作用结合形成多糖/蛋白质复合膜。 同时,SPI颗粒填充了CS单层膜表面的龟裂,使膜表面更加平滑和致密。 多糖/蛋白质双层结构的形成,为复合膜的进一步使用奠定了基础。
配比、溶液pH值、离子强度以及温度等是影响CS与SPI非共价作用的主要因素。 CS与SPI的结合作用最佳配比区间为0.2~0.8,最佳pH值范围为5.5~6.6,在较低的离子强度下(NaCl浓度<20 mmol/L),有利于形成具有紧凑结构的CS/SPI聚集体。 高离子强度的环境中,聚电解质之间的相互作用较弱,阻碍了聚集体的形成。 静电作用、疏水作用和氢键等弱相互作用是自组装的主要驱动力,其中蛋白质受热变性后与壳聚糖的疏水作用增强。 戊二醛的交联作用使CS/SPI纳米颗粒粒径收缩,同时造成粒径分布不均以及表面电荷的降低。 在pH=5.5最佳静电作用下,成功制备了CS/SPI双层膜。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|