共同通讯联系人:姜春杰,教授; Tel:0411-82156708; E-mail:jiangcj@lnnu.edu.cn; 研究方向:多酸合成与催化,生物质转化
制备了铁磁性Fe3O4基质,并引入磷钨酸尿素复合物制备了有机硫化物氧化催化剂(HPW-Urea/Fe3O4),并通过IR、XRD、Raman和TG等技术手段测定了磁性催化剂的物理化学和热学性质。 研究结果表明,在Fe3O4上引入HPW-Urea后,磷钨酸尿素复合物以Keggin结构存在于载体Fe3O4上,且和载体之间是化学键作用。 在以有机硫化物乙硫醇的正己烷溶液的H2O2氧化反应中,磷钨酸尿素复合物的引入提高了磁性Fe3O4对乙硫醇的氧化活性,并探讨了尿素在活性改善中的作用。
Co-corresponding author:JIANG Chunjie, professor; Tel:0411-82156708; E-mail:jiangcj@lnnu.edu.cn; Research interests:synthesis and catalysis of polyacid, biomass conversion
Oxidation catalysts of organic sulfide were synthesized by the ferromagnetic Fe3O4 matrix and phosphotungstic acid urea complexes(PAUC). The properties of products were characterized by IR, XRD, Raman and TG. With introduction of oxidation catalysts of organic sulfide, it is found that PAUC exists on Fe3O4 support in a Keggin structure and there is a chemical bond effect between them. If the H2O2 oxidation of ethanethiol proceeds in n-hexane, the oxidation activity of ethanethiol over ferromagnetic Fe3O4 matrix is increased in the presence of the PAUC. The effect of urea on activity has been discussed.
环境友好与绿色氧化技术是当前化学研究与开发的热点。 在众多氧化剂中,H2O2水溶液是一种价廉且环境友好的绿色氧化剂[1]。 硫醇或醚氧化得到磺酸是有机化工的重要中间体。 杂多酸(HPA)的酸性和氧化性可以控制在原子和分子水平上,其应用于有机硫化物氧化脱硫反应的研究已见报道[2,3,4]。 Sasaki等[3]报道了以负载于氟磷灰石上的磷钼酸四丁基铵为催化剂,利用过氧化尿将硫醚在无溶剂下氧化成亚砜和砜。 Li等[4]研究了磷钨酸(HPW)结合季铵阳离子催化4,6-二甲基二苯并噻吩十氢萘模拟油体系,有很好的有机硫氧化脱除效果。
磁性纳米材料作为一种新型功能复合材料具有吸附能力强、表面可修饰和易分离等特点,在酸催化和吸附分离等领域应用广泛[5]。 通过负载多酸制备成酸性或者氧化型磁性催化剂,兼具二者的双重特点,可通过外加磁场的方式将催化剂从反应体系中快速高效的回收,有效地解决了催化剂的分离问题。 因此,磁性特别是具有超顺磁特性的材料作为载体制备固体多功能催化剂迅速成为目前催化领域研究的热点[6]。 熊小龙等[7]在商品Fe3O4上包覆二氧化硅,浸渍HPW制备成了固体酸催化剂,在噻吩和辛烯组成模拟油品的烷基化脱硫反应中显示出了较好的脱硫反应性能。 尿素在氧化反应中应用已见文献报道[1],然而其应用于有机硫化物氧化脱硫反应的研究未见文献报道。 传统的多酸催化氧化脱硫研究通常以多酸或其衍生物为催化剂,以乙腈或二氯甲烷等毒性较强的有机物为萃取剂,经分离后实现高效脱硫。 在前期研究工作的基础上[8,9,10,11,12],本文选用磁性Fe3O4粉末与质子化的尿素与HPW相结合作为催化剂,以有机硫化物乙硫醇的正己烷溶液的氧化为探针反应评价其脱硫反应性能,在反应中以水和乙醇替代传统的高毒性乙腈等萃取剂,实现绿色环保的氧化脱硫技术,并探讨了催化剂的物理化学和热学性质。
D8 Advance型X射线多晶衍射仪(德国布鲁克AXS有限责任公司),TENSOR 27型傅里叶变换红外光谱仪(德国布鲁克光谱仪器来太公司),Invia型激光共焦拉曼光谱(英国雷尼绍公司),Pyris型热重/差热综合分析仪(珀金埃尔默仪器上海有限公司),THA-2000型微机硫氯分析仪(泰州金航分析仪器有限公司);PE2400CHN型元素分析仪(美国PE公司)。 所用试剂和药品均采购于国药集团化学试剂公司,分析纯,除HPW经重结晶外其它未经提纯直接使用。
磁性Fe3O4的制备:按Zhang等[13]方法,在磁力搅拌下用浓HCl酸化FeCl3和FeCl2的混合溶液,后逐滴加入NaOH溶液,用磁铁加速沉降过程和除去杂质,在60 ℃下烘干,得到产物磁性Fe3O4粉末。
HPW-Urea/Fe3O4的制备:配制含0.06 g的尿素水溶液50.0 mL,加入3.0 mol/L的HCl溶液10.0 μL,反应6 h后加入2.00 g HPW(HPW与尿素的摩尔比为1∶1.5)。 无机酸如盐酸在低温条件下与尿素形成盐酸脲复合物,HPW可以替代氯形成较稳定的HPW-脲素(HPW-Urea)复合物。 加入上述已制备好的4.00 g Fe3O4粉末,浸渍12 h,60 ℃烘干,在N2气保护下150 ℃焙烧6 h,ICP测定的结果表明 n(P)∶ n(W)∶ n(Fe)=1∶11.9∶400.8,催化剂记为HPW-Urea/Fe3O4。 作为对比,在含2.00 g HPW的50.0 mL水溶液中加入4.00 g Fe3O4粉末,后按相同条件干燥、焙烧后的催化剂记为HPW/Fe3O4。
在内衬聚四氟乙烯的不锈钢反应釜中加入催化剂0.28 g,0.02 mL H2O2(质量分数30%),二者接触0.5 h后加入 8.0 mL浓度为447.8 μg/g乙硫醇的正己烷溶液,2.0 mL乙醇,在一定温度下反应3 h,经水洗后测定产物中的硫含量。
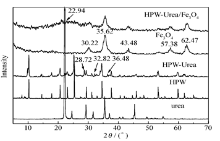
2.1.1 X射线粉末衍射分析图1为样品的XRD谱图。 合成的HPW-Urea的主要特征衍射峰与HPW基本一致,一些新的特征衍射峰,如28.7°、32.8°和36.48°等的出现表明二者之间形成HPW-Urea加合物。 与王光龙等[14]关于固体硫酸脲的研究类似,这3处衍射分别对应于(340)、(240)和(330)晶面的衍射。 磁性氧化物在30.2°、35.6°、43.5°、57.4°和62.5° 5个信号较强的衍射峰表明,制得的磁性材料的主要成分为Fe3O4,分别对应于(220)、(311)、(400)、(511)和(440)晶面[6](JCPDS No.01-076-5337)。 而HPW-Urea/Fe3O4复合材料的各个峰与Fe3O4的峰基本一致,表明在磁性Fe3O4上引入HPW-Urea后,其结晶度有所降低,但载体的结构没有改变。 另外,没有产生复合物新的晶体结构,表明HPW-Urea复合物高度的分散在磁性载体Fe3O4上,或者是当复合物的颗粒尺寸小于2 nm时在XRD谱中不能检测到其存在。
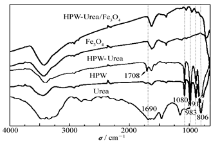
2.1.2 红外光谱分析图2为样品的红外谱图。 HPW在1080、983、891和806 cm-1的4个特征峰,分别对应于Keggin结构多酸阴离子P—O、 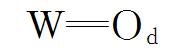
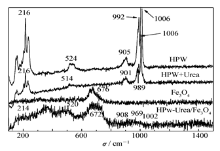
2.1.3 拉曼光谱分析图3为样品的拉曼谱图。 从图3可见,HPW的特征峰分别为1006、992、905、524和216 cm-1,是典型的Keggin结构特征振动峰。 引入尿素后,HPW-Urea的特征峰大体与HPW一致但有一定程度位移,另外在514 cm-1处的偏移,说明HPW与尿素以化学键结合[16]。 Raman光谱研究已确定磁铁矿Fe3O4的拉曼位移接近670 cm-1[17],所合成的磁性Fe3O4与文献结果基本一致。 HPW-Urea/Fe3O4复合材的Raman位移对应于1006、992、905、672、524和216 cm-1,表明在磁性载体Fe3O4上引入HPW-Urea后的多阴离子依然以Keggin结构存在,且二者间通过化学键结合,与IR表征结果一致。
2.1.4 热重分析(TG)
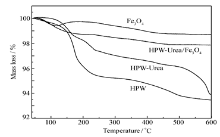
催化剂样品的热重分析TG曲线见图4。 HPW失重为三步失去水分子的过程。 第一步从40~150 ℃水分子的失重源于HPW结晶水分子的失重;第二步在350 ℃附近的失重为HPW中结合水分子的脱除;第三步在500 ℃附近的失重对应于HPW结构水分子的失重,通常认为是Keggin结构骨架的坍塌,与Maksimov[18]报道的结果一致。 HPW-Urea的失重过程和HPW基本保持一致,不同的是在300 ℃附近为尿素的分解过程;对于载体Fe3O4,150~300 ℃的增重比例低于2%,表明整个过程是Fe3O4在O2气气氛下转变为Fe2O3的过程,其余过程仅为水分子的脱除。 对于HPW-Urea/Fe3O4样品,第一步是从40~200 ℃的失重过程与HPW一致;第二步是从200~350 ℃,归属为失去水分子,这种水分子源于HPW与Fe3O4的Fe-OH的配合配位作用及尿素分解造成的失重;第三步在350~450 ℃附近有一个非常明显的失重,它对应于HPW的结构水分子的失重,通常认为是Keggin结构骨架的坍塌形成W-O物种。 TG分析结果表明,HPW-Urea/Fe3O4催化剂的热稳定温度高于350 ℃。
复合催化剂的氧化脱硫实验选用乙硫醇的正己烷溶液作为硫源,以H2O2为氧化剂的氧化脱硫体系,反应温度对脱硫反应活性影响的曲线如图5所示,磁性Fe3O4在30~70 ℃范围内活性随温度升高的幅度小,Fe3O4粉末的脱硫率为11.4%。 在Fe3O4上引入HPW后,反应温度对脱硫率的影响呈相同的规律,且反应活性有一定程度的提高,在80 ℃时达到43.1%。 而HPW-Urea/ Fe3O4复合材料在30 ℃的脱硫率为30.5%,高于载体磁性Fe3O4在80 ℃脱硫反应活性数据。 3种不同催化剂的氧化脱硫活性随温度的升高而增大,表明在反应温度范围内,乙硫醇的H2O2氧化反应为热力学有利反应,热力学和动力学因素同时起促进作用。 到达80 ℃反应时,三者均有一个明显的提升,HPW-Urea/Fe3O4复合材料的脱硫率为51.2%,磁性Fe3O4粉末的脱硫率为24.3%。 由于催化剂具有超顺磁性,在外加磁场作用下可将催化剂从反应体系中快速高效的回收,且催化剂重复使用3次脱硫率分别为51.0%、52.0%和50.9%,其脱硫活性未见降低,HPW-Urea/Fe3O4复合材料显示出了良好的活性及重复使用性能。
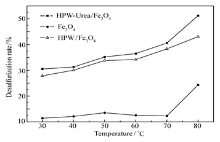 | 图5 HPW-Urea/Fe3O4复合材料与磁性Fe3O4粉末的脱硫率Fig.5 Desulfurization rate curve of samples n(O)/ n(S)=5; V( n-hexane)∶ V(ethanol)=4∶1; time=3 h |
在本研究中使用乙醇为助溶剂以提高有机硫分子和催化剂接触的概率,且在反应后可以通过水洗直接分离有机物,操作简便,无污染环境问题,是一个有机硫分子绿色的氧化工艺。 由于HPW强的氧化能力且反应被还原后易于被氧化回初始状态,从而实现催化剂反应过程的循环。 在反应过程中HPW假液相现象的存在也为其达到最佳的氧化活性提供了可能。 在催化剂制备过程引入了尿素,其作用有:1)在反应过程中尿素结合H2O2形成过氧化尿素,在极性有机溶剂中增加了与强极性氧化剂H2O2接触的概率,提高了磁性催化剂的反应活性;2)强B酸HPW能在水溶液中大幅度降低Fe3O4的结晶度,甚至反应后溶解于溶剂水分子中。这也是在反应过程中引入尿素的重要原因。
将酸化的尿素与HPW结合得到的HPW-Urea复合物,负载于以复合铁盐水解法制备的磁性铁氧化物粉末上。 XRD、IR和Raman表征的结果表明,磁性氧化物材料的主要成分是Fe3O4,HPW-Urea/Fe3O4复合材料中的各组分均以化学键结合,且复合材料的热稳定温度高于350 ℃,磷钨酸尿素复合物的引入提高了磁性Fe3O4对乙硫醇的氧化活性。 反应后可以通过水洗直接分离有机物,操作简便,无污染环境问题,是一个有机硫分子绿色的氧化工艺。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|