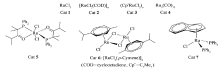
以邻氨基苯甲醇为原料进行催化脱氢反应,经过对催化体系的一系列筛选,最终采用[RuCl2( p-cymene)]2/AgOTf共催化体系,使邻氨基苯甲醇发生催化脱氢和芳基端炔发生交叉偶联反应,并以39%~47%的收率获得合成一系列2-芳基喹啉衍类生物,发展了邻氨基苯甲醇与芳基末端炔烃合成喹啉衍类生物的新方法,是对喹啉类衍生物合成方法的一个重要补充。
By using o-aminophenyl methanol as the starting material and undergoing a dehydrogenation reaction, [RuCl2( p-cymene)]2/AgOTf was finally employed as the co-catalyst system upon a systematical screening of catalysts, which enables the dehydrogenation of o-aminophenyl methanol to undergo a cross-coupling reaction with terminal aryl alkynes, affording a series of 2-aryl quinolines in 39% to 47% yields. The study has demonstrated a new method for the synthesis of quinolines from o-aminophenyl methanol and terminal aryl alkynes, which is an important complement to the synthesis of quinoline derivatives.
喹啉及其衍生物是一类重要的含氮杂环化合物[1]。 在众多具有重要用途的天然产物和合成化合物中均含有喹啉这一基本骨架[2]。 同时,喹啉类衍生物已被证实具有一系列独特的生物、药理活性,如抗菌、抗炎、抗病毒以及镇痛[3,4]。 近年来,喹啉类化合物还被用于艾滋病的治疗[5,6]。 传统合成喹啉的方法包括Skraup法、Doebner-von Miller法、Friedlander法以及Combes反应等[7,8,9]。 然而,这些方法通常是在高温、强酸或强碱等条件下进行的,特别是在工业化的生产过程中,其合成存在着腐蚀设备、污染环境等不足之处。 因而,发展简便、高效、低污染的喹啉衍生物合成方法仍具有重要的科学意义。
近年来,由于过渡金属在均相催化反应中的高效性,利用一些过渡金属如铑[10]、铁[11]、锌[12]、铱[13]、铜[14]和钌[15]等,发展喹啉衍生物的新合成方法也相继见诸报道。 这些方法与传统的合成法相比,虽然避免了浓酸或者浓碱的使用,但其合成需要对反应底物进行预制备,或者需要使用含卤试剂,这必然会造成操作过程的复杂化、降低反应的原子经济性、产生对环境不利的影响。 因而,发展一种原子经济性高、对环境污染小、简便且直接的合成新方法有着非常重要的意义。
邻氨基苯甲醇是一种含有醇羟基和氨基的双官能团化合物,在有机化学、药物合成中有着广泛的用途,并且它也是一种重要化工中间体[16]。 本文通过对催化体系的一系列筛选,最终发展了一种对醇羟基高效脱氢的钌/酸共催化体系[17,18,19,20,21],可使邻氨基苯甲醇发生催化脱氢和芳基端炔发生交叉偶联反应合成一系列2-芳基喹啉衍类生物(Scheme 1)。 基于此,作者对这一喹啉衍生物的新合成方法进行介绍。
 | Scheme 1 Synthesis of quinoline derivatives via catalytic dehydrogenation of o-aminoarylmethanol and cyclization with terminal arylalkynes |
SGW-X4型数字显示显微熔点测定仪(上海五久自动化设备有限公司),温度计未校正;FTLA2000型红外光谱仪测定(美国ABB公司),KBr压片;Bruker-400型核磁共振仪(德国Bruker公司),CDCl3为溶剂,TMS为内标;37 μm的GF254薄层硅胶板(青岛海洋化工厂),在波长为254 nm的紫外灯下观测;所有的试剂均由百灵威、国药集团和Aldrich等公司购买,使用前无需进一步纯化。
在50 mL Schlenk管中加入2-氨基苯甲醇1(1.0 mmol,123 mg),芳基末端炔2(1.5 mmol),添加剂苯胺4(1.5 mmol,140 mg),Cat 6(0.005 mmol,3.1 mg),三氟甲磺酸银(0.1 mmol,26 mg),溶剂DMF(1 mL)搅拌,加热至120 ℃,反应16 h。 等反应体系冷却至室温后,利用薄层色谱法分离体系中的产物,其中展开剂 V(乙酸乙酯)∶ V(石油醚)=1∶18混合溶剂,用乙酸乙酯将目标组分从硅胶上洗脱下来,旋蒸除去溶剂,得到产物3。
2-苯基喹啉(3a)[22]:淡黄色固体;mp 82~83 ℃(文献值[17] 84~85 ℃);1H NMR(400 MHz,CDCl3), δ:8.20~8.02(m,4H),7.83~7.73(m,2H),7.65(ddd, J=8.4,6.9,1.4 Hz,1H),7.49~7.37(m,4H);IR(KBr), σ/cm-1:3054,1579,791,691;MS(EI, m/z):205[M]+。
2-(4-氟苯基)喹啉(3b)[22]:黄色固体;mp 94~95 ℃(文献值[17] 92~93 ℃);1H NMR(400 MHz,CDCl3), δ:8.10(ddd, J=11.4,8.7,5.4 Hz,4H),7.75(d, J=8.6 Hz,2H),7.65(t, J=7.0 Hz,1H),7.13(t, J=8.7 Hz,2H);IR(KBr), σ/cm-1:3068,1593,852;MS(EI, m/z):223[M]+。
2-(4-氯苯基)喹啉(3c)[23]:黄色固体;mp 108~111 ℃(文献值[17] 112~114 ℃);1H NMR(400 MHz,CDCl3), δ:8.23(d, J=8.6 Hz,1H),8.19~8.09(m,3H),7.87~7.81(m,2H),7.74(t, J=7.0 Hz,1H),7.52(dd, J=20.3,7.8 Hz,3H);IR(KBr), σ/cm-1:3050,1632,816;MS(EI, m/z):239[M]+。
2-(4-甲基苯基)喹啉(3d)[22]:黄色固体;mp 80~82 ℃(文献值[17] 81~82 ℃);1H NMR(400 MHz,CDCl3), δ:8.11(dd, J=17.4,8.6 Hz,2H),8.00(d, J=8.2 Hz,2H),7.77(dd, J=19.8,8.3 Hz,2H),7.65(t, J=7.0 Hz,1H),7.44(t, J=7.0 Hz,1H),7.26(d, J=7.9 Hz,2H),2.37(s,3H); IR(KBr), σ/cm-1:3061,2916,2850,1595,833;MS(EI, m/z):219[M]+。
2-(3-甲基苯基)喹啉(3e)[22]:黄色液体;1H NMR(400 MHz,CDCl3), δ:8.19(dd, J=11.6,8.6 Hz,2H),8.01(s,1H),7.92(d, J=7.8 Hz,1H),7.84(dd, J=18.2,8.3 Hz,2H),7.72(ddd, J=8.4,6.9,1.4 Hz,1H),7.52(ddd, J=8.0,6.9,1.1 Hz,1H),7.41(t, J=7.6 Hz,1H),7.28(d, J=7.5 Hz,1H),2.48(s,3H);IR(KBr), σ/cm-1:3061,2920,2850,1619,868,780,619;MS(EI, m/z):219[M]+。
2-(4-叔丁基苯基)喹啉(3f):黄色液体;1H NMR(400 MHz,CDCl3), δ:8.11(dd, J=14.9,8.6 Hz,2H),8.05~7.96(m,2H),7.77(dd, J=19.7,8.3 Hz,2H),7.64(ddd, J=8.4,6.9,1.4 Hz,1H),7.50~7.41(m,3H),1.31(s,9H);13C NMR(101 MHz,CDCl3), δ:152.56,136.95,136.66,130.02,129.70,129.57,127.45,127.31,127.12,126.35,126.10,125.83,118.99,31.31,29.72;IR(KBr), σ/cm-1:3060,2966,2919,1598,1498,850;MS(EI, m/z):261[M]+;HRMS(ESI):计算值C19H19N[M+1]+:261.1517;实测值:261.1508。
选择2-氨基苯甲醇1(1 mmol)和苯乙炔2a(1.5 mmol)作为模型反应,以三氟甲磺酸为酸催化剂(20%摩尔分数),DMF为反应的溶剂,苯胺为反应的添加剂,在120 ℃下反应16 h,发现并没有预期的产物生成(表1,entry 1)。 在上述反应条件下加入摩尔分数1%的RuCl3,发现有少量的目标产物生成,其产率为10%(表1,entry 2)。 若只用RuCl3为单一的催化剂,不加任何酸催化剂的条件下,亦没有相应的产物生成(表1,entry 3)。 在此条件与反应不加苯乙炔的情况下,我们检测到了少量邻氨基苯甲醛的生成。 这些实验结果表明钌催化剂在整个反应中起到了催化醇脱氢[15,16]的作用,而酸催化剂则是促使相应的邻氨基醛和芳基末端炔烃交叉偶联反应生成2-芳基喹啉产物[18]。
| 表1 合成化合物3a的反应条件优化 a Table 1 Optimization of reaction conditions for the synthesis of compound 3a a |
将其它6种钌化合物(Scheme 2,Cat 2~7)用于催化该模型反应,探索它们对反应产率的影响(表1,entries 4~9)。 结果显示,[Ru(p-Cymene)]2(Cat 6)的催化效果最好,产率较高,达到36%(表1,entry 6)。 进一步,以Cat 6作为催化剂,探索各种酸催化剂对反应产率的影响(表1,entries 10~12),从表中的结果可明显地看出,AgOTf的催化效果最好,收率可达到47%(表1,entry 12)。 以Cat 6和AgOTf作为共催化剂,筛选各种有机溶剂对产物3a产率的影响,实验结果表明其它有机溶剂均没有DMF效果好(表1,entries 13~15)。 为了能提高产物的产率,尝试增加钌催化剂和酸催化剂的用量(表1,entries 16~17),产物3a的产率并没有升高反而降低了。
考虑添加剂胺对反应产率的影响,当将苯胺替换成对甲苯胺(表1,entry 18)时,产物3a的产率稍有降低,不加入苯胺,结果并没有相应的产物生成(表1,entry 19),这表明添加剂胺的加入对反应起着重要的促进作用。
基于上述实验探索,最优反应条件为:2-氨基苯甲醇1(1 mmol),苯乙炔2a(1.5 mmol)催化剂Cat 6(0.01 mol),AgOTf(0.2 mmol),添加剂苯胺(0.5 mmol),DMF为反应溶剂,反应温度120 ℃。
在得到最优反应条件后,作者对该合成方法进行了底物拓展。 特别检验了带有不同取代基的末端苯乙炔对该反应的适用性。 实验结果显示(表2,entries 1~6),所有反应均能顺利进行得到预期的2-芳基喹啉产物。 同时,还发现苯乙炔苯环上的取代基团对反应有着显著的影响,当其带有吸电子电子基团时(如氟,氯),反应可于相对较短的反应时间内(14 h)以较高的分离产率得到目标产物(表2,entries 2~3);而芳基端炔的苯环上带有供电子基团时(如甲基,叔丁基),反应需要延长至18 h方可获得较为满意的产率(表2,entries 4~6)。 这些实验结果表明,带有缺电子基团的苯乙炔的反应活性高于带有给电子基团的苯乙炔,这可能是吸电子基团可以活化炔烃三键,有利于氨基对炔烃的加成,从而形成相对较为活泼的反应中间体。 值得一提的是,所得的6个产物中,因芳基靠近喹啉骨架中的氮原子,这些产物可用于合成各种环金属化的金属有机配合物或金属有机材料[19]。 同时,该合成2-芳基喹啉的方法简便易行,这为合成各种具有重要应用价值的喹啉化合物提供了一个合成方法的选择。
| 表2 钌/酸共催化由邻氨基苯甲醇和芳基端炔合成喹啉衍生物 Table 2 Ruthenium/acid co-catalyzed synthesis of quinoline derivatives from o-aminoarylmethanol and terminal arylalkynes |
以[Ru( p-Cymene)]2/AgOTf为高效的共催化体系,实现了催化邻氨基苯甲醇和带有不同取代基的芳基端炔之间的偶联环化反应,经一锅法可简便、直接合成一系列2-芳基喹啉类衍生物。 该合成方法与传统合成法相比,具有反应条件较温和、操作简便等优点,这是对喹啉类衍生物合成方法的一个重要补充。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|