采用四因素、三水平的方法研究了过碳酰胺分子合成中物料比、反应温度、反应时间、稳定剂的种类对合成收率的影响,获得了合成的最佳工艺条件。 在最佳合成条件下,测得过碳酰胺的产率可达到99%,活性氧含量最高可达到17.5%。 通过热分析方法研究了过碳酰胺分子热稳定性。 研究表明,温度超过65 ℃过碳酰胺含量和含氧量均迅速下降。 利用X射线单晶衍射仪测定了其晶体结构,使用Diamond软件解析出过碳酰胺分子的三维空间超分子结构及其氢键的连接方式。
The method of four factors and three levels was used to study the influence of the material ratio, reaction temperature, reaction time and stabilizer in order to obtain the optimal process condition of percarbamide. The results show that the yield of percarbamide is 99%,and the oxygen content is 17.5% under the optimmal synthetic condition. The thermal stability of percarbamide was investigated by thermal analysis. The results show that the content of oxygen and percarbamide decreases rapidly when the temperature exceeds 65 ℃. Finally, the crystal structure was determined by X-ray diffraction, and the software, Diamond, was used to describe the three-dimensional supramolecular structure of percarbamide and the connection mode of hydrogen bond.
过氧尿素(Urea Peroxide),简写为UP,又称过碳酰胺,是过氧化氢和尿素的加合物(CO(NH2)2·H2O2, Mr=94.07)。 其水溶液稳定性好,兼有过氧化氢和尿素的性质,在水中能缓慢放出O2气,作用时间长,在一定的条件下控制氧气产生的速度,则可用于医院急救的供氧源,作为供氧剂;过碳酰胺有较强的去污能力,可用作漂白剂;0.75%过碳酰胺水溶液还可抑制细菌与霉菌的生长,残留无刺激,可用作杀菌剂;过碳酰胺还可用作打印油墨中的催干剂,提高打印效果及质量[1,2,3,4]。
过碳酰胺是高附加值精细化工产品,相关的生产文献报道较多。 谭淑珍等[5]报道在 n(尿素): n(过氧化氢)=1:1.4,反应温度为30 ℃,反应时间40 min条件下,过碳酰胺的产率为77%;刘立华等[6]报道 n(尿素): n(过氧化氢)=1:1.3,反应温度30 ℃,反应时间40 min,过碳酰胺的产率为87.32%。 大多数文献中过碳酰胺合成的产率在75%~95%之间,但适宜的工艺条件说法不一[7,8,9,10,11,12,13,14]。 近年来的研究主要集中在过碳酰胺作为环境友好的氧化剂在烯烃、芳香化合物等氧化反应领域的应用[15,16,17,18,19,20,21]。 本文通过正交试验极差分析的方法得出了过碳酰胺合成(产率、活性氧含量)的最优条件,过碳酰胺的产率为99%,活性氧含量最高可达到17.5%。
对于过碳酰胺分子的晶体结构研究,Lu等[21]在1941年提出了过碳酰胺分子中的氢键一半用于连接分子,另一半用于形成折叠态。 Dobado等[22]在1998年利用MP2和DFT量子力学法计算了UP的环状化合物结构。 到目前为止,尚无过碳酰胺分子三维空间立体结构研究的相关报道。 为此,我们通过Bruker Smart APEX II CCD仪器测得过碳酰胺的晶体结构,使用Diamond软件解析出过碳酰胺分子的三维空间立体结构。 由于过碳酰胺受热易分解,不利于运输和储存,因此,我们采用了热分析的方法对其热稳定性进行了研究。
JASCO FT/IR-480型傅里叶变换红外光谱仪(日本JASCO公司),KBr压片,波数400~4000 cm-1);Bruker AXS SMART APEX II CCD型X射线单晶衍射仪(德国Bruker AXS公司);X射线粉末衍射仪(PXRD,德国Bruker AXS公司)。 尿素(开原化学试剂厂),过氧化氢30%(质量浓度) (天津市科密欧化学试剂有限公司),酒石酸(TA,沈阳市化学试剂厂),EDTA(阿拉丁化学品公司),高锰酸钾(沈阳化学试剂厂),草酸钠(沈阳天源化工有限公司),98%浓硫酸(天津市科密欧化学试剂有限公司),冰醋酸(广东光华化学厂有限公司),碘化钾(天津市大茂化学试剂厂),钼酸铵(北京化工厂),五水合硫代硫酸钠(阿拉丁化学品公司),十二烷基磺酸钠(阿拉丁化学品公司)。 上述试剂均为分析纯试剂。 三聚吡唑硼酸钾(TP,实验室合成,纯度98%)。
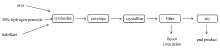
在200 mL烧杯中,加入一定量的尿素,缓慢加入相应量的过氧化氢,控制反应温度。待尿素完全溶解后,加入少量稳定剂,搅拌30 min。 加入少量包膜剂(十二烷基磺酸钠),搅拌5 min后反应结束。 将产物放入冰水浴中冷却30~40 min,得白色糊状固液混合物。 抽滤,得白色粉末状结晶固体,在30 ℃的烘干器中烘干,即得到成品。
1.3.1 高锰酸钾滴定测活性氧含量 参考文献[6],准确称取100 mg样品置于50 mL小烧杯中,加入少许蒸馏水使之溶解,加入5 mL 1:1硫酸,混合均匀后,用已知浓度的高锰酸钾溶液滴定,至样品溶液微显浅紫色1~2 min即可。 每毫升0.02 mol/L高锰酸钾溶液相当于0.8 mg的活性氧。
1.3.2 过碳酰胺含量测定 参考文献[6],准确称取100 mg样品置于250 mL锥形瓶中,加入25 mL蒸馏水使之溶解,加入5 mL冰醋酸,混合均匀后加入1.5 g碘化钾和1滴钼酸铵试液,密闭并置于阴暗处放置10 min,用0.050 mol/L硫代硫酸钠溶液滴定游离的碘,接近终点时加入3 mL淀粉指示剂,溶液呈无色。 每毫升0.05 mol/L硫代硫酸钠溶液相当于3.1 mg过碳酰胺。
选择晶体大小为0.24 mm×0.48 mm×0.54 mm的化合物分别在Bruker Smart APEX II CCD仪器上、Mo Kα光源( λ=0.071073 nm)、室温下收集单晶的衍射数据。 对于化合物过碳酰胺,共收集到2373个衍射点,,其中独立衍射点542个,强点419个( I>2 σ( I))用于结构解析。 衍射强度数据经Lp 因子校正,晶体结构由直接法和差值Fourier合成法解出。 对所有非氢原子坐标和各向异性温度因子进行全矩阵,最小二乘法修正,氢原子(不包括水分子上的氢原子)坐标由理论加氢程序确定,水分子上的氢原子坐标通过查傅里叶图确定。 所有计算均用SHELX-97程序在Pentium(Ⅲ) PC计算机上进行。 化合物的晶体学参数列于表1,其键长和键角列于表2,化合物的分子结构及氢键图用Diamond 3.2程序绘制。(CCDC:1437305)
| 表1 化合物晶体学及精修数据 Table 1 Crystallographic data of the complex |
| 表2 化合物过碳酰胺的主要键长*和键角 Table 2 Bond lengths and angles of percarbamide |
为了确定合成过碳酰胺产率及活性氧含量的最佳工艺条件,通过单因素试验得到各因素的最佳值,根据单因素试验结果设计正交试验L9(34)。 试验因素水平见表3,过碳酰胺产率直观分析见表4,活性氧含量的直观分析见表5。
| 表3 过碳酰胺产率正交试验因素水平 Table 3 Orthogonal experimental factor level of percarbamide yield |
| 表4 影响过碳酰胺产率正交试验结果的极差分析 Table 4 Range analysis of orthogonal experiment results of percarbamide yields |
三个因素的优水平组合A3B3C3D1为本试验的最优水平组合,即合成过碳酰胺产率的最优工艺条件为原料摩尔比0.65:1,温度40 ℃,反应时间40 min,酒石酸作为稳定剂。 测得过碳酰胺产率为99%。
| 表5 影响含氧量正交试验结果的极差分析 Table 5 Orthogonal test range analysis of oxygen of percarbamide |
3个因素的优水平组合A3B2C3D3为本试验的最优水平组合,即活性氧含量的最优工艺条件为原料摩尔比0.75:1,温度35 ℃,反应时间40 min,三聚吡唑硼酸盐作为稳定剂。 测得活性氧含量为17.5%。
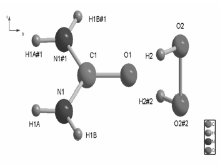
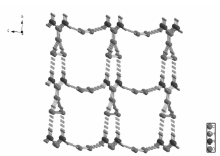
X射线晶体学研究表明,化合物是由尿素和过氧化氢两部分构成,见图1。 过碳酰胺分子之间通过氢键连接,化合物存在2种类型的氢键:1)O—H••••O ,O2—H2••••O1;2)N—H••••O,N1—H1A••••O2;N1—H1B••••O2;分子通过O2—H2••••O1和N1—H1A••••O2氢键连接成无限一维链状结构,见图2。 进一步再通过N1—H1B••••O2将链状结构连接到一起,构成无限二维面状结构,见图3。 最后形成三维超分子结构,见图4。
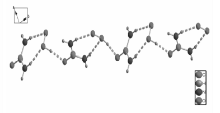 | 图2 过碳酰胺通过氢键形成的无限一维链状结构(部分氢原子已经省略)Fig.2 Unlimited one-dimensional chain structure formed by hydrogen bonds(partial hydrogen atoms were omitted) |
 | 图3 过碳酰胺通过氢键形成的无限二维面状结构(部分氢原子已经省略)Fig.3 Infinite two-dimensiona planar structure formed by hydrogen bonds(partial hydrogen atoms were omitted) |
红外光谱表明,波数3353.11和3448.64 cm-1归属为N—H的伸缩振动吸收峰( νN—H);波数3260 cm-1归属为O—H的伸缩振动吸收峰( νO—H)波数1686 cm-1归属为C=O的伸缩振动吸收峰( νC=O);波数为1617 cm-1归属为N—H的弯曲振动吸收峰( δN—H);波数1162 cm-1归属为C—N的伸缩振动吸收峰( νC—N)。
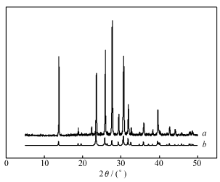
图5为晶体化合物过碳酰胺的实验数据和单晶模拟数据的PXRD谱图。 由图5可知,化合物的粉末PXRD的实验峰值和模拟数据的峰值能很好的吻合在一起,这表明化合物为纯相,不含杂质。 采用熔点测量仪测定晶体熔点为78.5~78.8 ℃,熔程变化范围小,说明晶体纯度较高。
PXRD模拟数据来源:利用Mercury软件通过单晶结构数据得到的模拟峰。
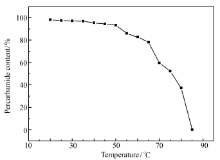
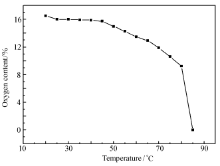
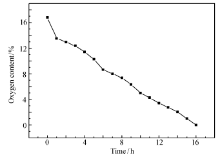
通常情况下,过碳酰胺在高温下不稳定,遇热易分解。为了更好地运输和储存过碳酰胺,本文研究了不同温度和时间对过碳酰胺含量和活性氧含量的影响,结果见图6和图7。
由图6、7可以看出,当加热温度低于60 ℃,过碳酰胺及其活性氧含量分解率较低,在温度达到65 ℃时,分解速率迅速增大,过碳酰胺含量低于65%,活性氧含量低于12%。在此基础上本实验研究了65 ℃条件下过碳酰胺含量及含氧量随时间变化曲线,结果见图8、图9。
通过正交试验,优化了过碳酰胺合成反应的最佳条件。在原料比0.75:1、温度35 ℃、反应时间40 min,三聚吡唑硼酸盐作为稳定剂条件下,活性氧含量高达17.5%,过碳酰胺含量为98%;热稳定性研究表明,随着温度的升高,活性氧含量和过碳酰胺含量均下降。 温度超过65 ℃时活性氧含量和过碳酰胺含量迅速下降。 温度低于60 ℃有利于过碳酰胺的储存和运输。 通过X射线单晶衍射仪测定其晶体结构仪测定得到两种类型的氢键,解析出过碳酰胺晶体的三维空间超分子结构。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|