研究了Ce(Ⅲ)离子与巴比妥钠形成的配合物对双(对硝基苯基)磷酸酯(BNPP)的催化水解作用。 结果表明, Ce(Ⅲ)与巴比妥钠形成的配合物对BNPP的水解具有很高的催化活性,可使BNPP水解速率提高至自发水解时的1.52×108倍。 体系的pH值和温度对催化水解反应的影响,发现在温度为25 ℃和pH值为8.50的条件下,催化效果最佳。
Hydrolysis of bis( p-nitrophenyl) phosphate(BNPP) catalyzed by Ce(Ⅲ)-barbitone complex was explored. The results indicate that the Ce(Ⅲ)-barbitone complex exhibits excellent catalytic activity for BNPP hydrolysis. The complex can increase the rate of the BNPP hydrolysis by a factor of 1.52×108 times compared to that of the spontaneous hydrolysis. The effect of temperature and pH on the catalytic activity of Ce(Ⅲ)-barbitone complex for BNPP hydrolysis was also investigated. It is found that the optimal catalytic condition is at 25 ℃ and pH 8.50.
在磷酸酯水解酶中常见的中心金属离子主要是Zn(Ⅱ)、Mg(Ⅱ)和Mn(Ⅱ)等少数几种[1],以三价或更高价态金属离子作为辅因子的酶非常少见。 随着研究的不断深入,人们已经不再局限于生物相关性离子上。 每种金属离子均具有自己独特的性质,在催化水解过程中可以揭示不同金属离子的作用,并可能成为一种有用的生物工程试剂。 在寻找高效人工酶的过程中,一些过渡金属元素,如:Co(Ⅲ)、Co(Ⅱ)、Pt(Ⅱ),以及稀土金属元素,如:Er(Ⅲ)、La(Ⅲ)、Ce(Ⅲ)等金属离子引起了人们的关注[2,3,4,5,6]。
在金属中心为稀土离子的研究中,一些含有N和O作为电子供给体的大环多胺[7]、含氧氮杂环以及多种Schiff碱[8,9]配体常被用于稳定稀土离子。 研究者还研究了在大环四胺配体上连接含有不同基团(包括醇羟基—OH、氨基—NH2)的侧链,考察它们与Ln(Ⅲ)系离子形成配合物对磷酸酯催化水解的活性。 动力学分析表明,它们是通过类似于过渡金属配合物催化的金属羟基机理来完成的。 也有一些中性的简单小分子被用来稳定Ln(Ⅲ)系离子,如:三羟甲基氨基甲烷(Tris)、二(2-羟乙基)亚胺基三(羟甲基)甲烷(Bis-Tris)、1,3-双((三羟甲基)甲基氨基)丙烷(Bis-Tris propane)、 N-二(羟乙基)甘氨酸等,结果证明他们均在一定程度上成为磷酸酯水解酶的有效模型物[10]。
巴比妥钠(BS)作为一种在医药、塑料及有机合成等工业领域均有着重要应用的生化试剂,在生物学上常用来配制缓冲溶液及细胞培养液等[11,12,13]。 BS的分子结构中存在着1个两氮六元环、2个羰基和1个带负电荷的氧原子,有足够的电子供给体与稀土离子配位形成配合物,从而保持其在碱性水溶液中的稳定。 BS作为全新的一种配体,有望为磷酸酯水解酶的模拟工作开辟新的热点。
本文考察了BS对Ce(Ⅲ)的稳定作用,选择了催化效果最好的Ce(Ⅲ)-BS配合物体系,测定其等摩尔连续变换法(Job法)曲线,推断出活性物种中Ce(Ⅲ)与BS的配比,对催化水解的产物进行了定量确认,并考察了体系pH值和温度等因素对催化活性的影响。
氢氧化钠(分析纯)、巴比妥钠(化学纯)和抗坏血酸(AR)购于上海化学试剂有限公司;盐酸(AR)购于上海振兴化工二厂;硝酸、酒石酸锑钾半水合和硫酸购于国药集团化学试剂有限公司;钼酸铵(AR)购于天津市化学试剂四厂;六水合硝酸铈(AR)购于天津市光复精细化工研究所;DNA的模型物双(对硝基苯基)磷酸酯(BNPP)的合成参照文献[14,15]。 UV-1800型紫外可见分光光度计(岛津国际贸易有限公司)。
等摩尔连续变换法(Job法)[16,17]:此方法要求金属离子和配体的总浓度保持不变,只改变二者之间浓度比例。 本实验中选择Ce(Ⅲ)离子(M)与巴比妥钠(L)的总浓度[M]+[L]=1.0×10-2 mol/L。 逐渐改变二者之间的浓度比例,配制成[M]/{[M]+[L]}依次为0.1、0.2、0.3、0.35、0.4、0.5、0.6、0.7、0.8和0.9的配合物溶液,并按照动力学方法测试它们对等体积的BNPP水解的催化效果,将结果用最小二乘法拟合换算成表观速率常数,做出Job曲线。
标准钼蓝法:此方法是为了测量溶液中磷的总含量。 按照GB11893-1989的方法操作,配制钼酸铵溶液和100 g/L的抗坏血酸溶液。 钼酸铵溶液的配制方法:在 V(H2SO4): V(H2O)=1:1的300 mL硫酸中缓缓倒入130 g/L的钼酸铵溶液100 mL,然后再倒入浓度为3.5 g/L的酒石酸锑钾溶液100 mL,混匀后在棕色瓶中冷处贮存。 在测试时先向待测液中加入1 mL抗坏血酸溶液混匀,30 s后加2 mL钼酸铵溶液充分混匀。 室温下放置15 min后,在700 nm波长下,以水做参比测定吸光度,从标准曲线上查得磷的含量,磷标准曲线用磷酸二氢钾测试绘制。
采用配有超级恒温装置的紫外可见分光光度计进行动力学测定。 取2 mL Ce(Ⅲ)离子储备液按照0.35的配比与BS储备液混合并定容至10 mL,当混合溶液达到指定温度后。 再将10 mL的BNPP溶液加入到溶液中开始反应,同时开始测量400 nm处吸光度( A)随时间的变化。 反应在准一级条件下进行(Ce(Ⅲ)配合物溶液浓度远高于反应底物浓度),通过测量400 nm处的吸光度跟踪反应进程。 用ln ( A∞- At)对时间t作图(A t和A∞分别表示反应溶液在 t和无穷大时刻在400 nm处的吸光度),采用最小二乘法拟合得到表观速率常数 kobsd。
为了证明BS与Ce(Ⅲ)之间有配位作用,定量地测定了Ce(Ⅲ)溶液、BS溶液以及二者混合溶液的紫外-可见吸收光谱,如图1所示。 在图1谱线 a中,可以观察到200 nm附近的Ce(Ⅲ)的 d-d跃迁产生的吸收峰;由图1谱线 b可以看出,由于BS本身呈弱酸性,自身在酸性条件下不电离,在189 nm处出现羰基C=O的π-π*跃迁产生的强吸收峰,在240 nm附近出现C=N共轭体系的吸收峰;混合溶液(图1谱线 c)中在200 nm附近出现了一个较强的峰,但各个峰值并不是前二者的单纯相加,Ce(Ⅲ)与BS混合之后,BS中带负电荷的氧原子作为助色团与Ce(Ⅲ)形成配位在240 nm处出现强吸收峰,这说明Ce(Ⅲ)与BS发生了配合作用,形成了配合物。
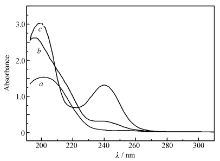 | 图1 Ce(Ⅲ)( a)、BS( b)及Ce(Ⅲ)-BS( c)配合物的紫外可见吸收光谱Fig.1 UV-visible absorption spectra of Ce(Ⅲ)( a), BS( b) and Ce(Ⅲ)-BS( c) complex |
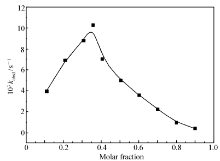
Job曲线可以反映出催化活性最强的物种内金属离子与配体之间的化学计量比。 在Ce(Ⅲ)与BS的总浓度[M]+[L]=1.0×10-2 mol/L的条件下,逐渐改变二者之间的浓度比例,按照动力学方法测试它们对等量的BNPP水解的催化效果,将结果用最小二乘法拟合换算成表观速率常数 kobsd。 然后以表观速率常数对金属离子的摩尔分数 x=[M]/{ [M]+[L] }作图,得到Ce(Ⅲ)-BS配合物催化BNPP水解的Job曲线(图2)。 由Job曲线可知,在Ce(Ⅲ)与BS配合体系中,当 x=0.35时,即[M]:[L]=1:2时,Ce(Ⅲ)与BS配合物催化BNPP水解的能力最强。 因此,此体系的催化活性物种中Ce(Ⅲ)与BS的配比是1:2。
为了比较在相同条件下Ce(Ⅲ)与BS的配合物对BNPP水解的催化效果,选择了pH=8.50、25 ℃的固定外界环境,比较了Ce(Ⅲ)、BA和配合物对BNPP水解速率,结果如表1所示。
| 表1 Ce(Ⅲ)与BS形成的配合物对BNPP的催化水解速率常数的影响 Table 1 The effect of complexes of Ce(Ⅲ) and BS on the rate constant of BNPP hydrolysis |
从表1可以看出,配体BS本身基本没有催化效果,Ce(Ⅲ)单独存在时,可将BNPP水解的速率提高5.52×105倍。 通过比较发现,催化效果最好的是Ce(Ⅲ)-BS复合体系,使BNPP水解的反应速率提高了1.52×108倍,表明Ce(Ⅲ)与BS配合物的形成有利于催化效果的提升。
根据反应方程式(1),一个BNPP分子首先水解生成一份子的磷酸单酯(NPP)和一分子的对硝基苯酚,然后磷酸单酯(NPP)再水解生成一分子的磷酸根和另一个对硝基苯酚分子。 因此,理论上1 mol BNPP水解的产物是2 mol对硝基苯酚和1 mol磷酸。 对硝基苯酚的含量可以用紫外可见光谱中400 nm处的吸光度进行测定,结果表明,对硝基苯酚的浓度约为2.82×10-4 mol/L;磷酸的存在与否以及含量用标准钼蓝法测得其浓度为1.38×10-4 mol/L。 因此,从测试结果可知,产物以磷酸/对硝基酚为主,其摩尔比约为1:2,证明了BNPP的水解是按照方程式(1)进行的。
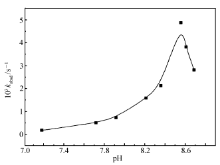
pH值是磷酸酯水解酶产生作用的一个重要影响因素,考察了Ce(Ⅲ)-BS体系在不同pH值条件下催化BNPP的水解速率。
由图3可以看出,随着体系pH值的增加,Ce(Ⅲ)-BS体系对BNPP的催化水解呈现“先扬后抑”的曲线。 pH值小于8.2时,BNPP的水解速率随着pH值的增加在不断增大,但是增加的速率比较缓慢;当pH值大于8.2时,BNPP的水解速率迅速增加,这是具有催化活性的金属-羟基配合物形成的标志。 在pH值约为8.5时速率达到最大值;而在pH值大于8.5之后,BNPP的水解速率却随着pH值的增加在迅速减小,可能是当pH值增大到一定程度之后,Ce(Ⅲ)-BS配合物变得不稳定,其中Ce(Ⅲ)与氢氧根离子—OH发生水解,从而造成了溶液中活性物种大幅减少。
天然酶的活性总是在一个有限的温度范围内体现,作为影响酶活性的一个重要因素,研究了在25~37 ℃温度范围内,模拟酶Ce(Ⅲ)-BS体系催化BNPP水解的表观一级速率常数的变化,结果如表2所示。 从表2可以看出,在设定的温度范围内,随着反应体系温度的增加,BNPP水解的表观速率常数也随之增加。 因为温度的升高加速了配合物以及反应底物BNPP的分子运动,从而加速了水解反应的进行。
| 表2 Ce (Ⅲ)-BS配合物催化BNPP水解的准一级速率常数随温度变化情况 Table 2 Psuedo first-order rate constant changes of BNPP hydrolysis catalyzed by Ce(Ⅲ)-BS complex with temperature |
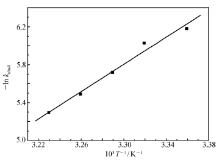
根据速率常数 kobsd与温度的关系和阿伦尼乌斯式(2)、(3)可以计算催化反应的表观活化能。
式中, Ea为催化反应的表观活化能, A为指前因子。
式(2)重排后可得式(3):
以-ln kobsd对1/ T作图,得到图4。 图中直线的斜率和截距分别为 Ea/ R和-ln A,因此得出,Ce(Ⅲ)-BS配合物催化BNPP水解的表观活化能为59.24 kJ/mol。
在金属配合物模拟磷酸酯水解酶的研究中,不同的金属配合物表现出了不同的水解机理。 一般而言,催化机理主要有以下几种类型:1)金属-羟基机理,又称为Lewis酸催化机理;2)金属-氢氧根离子机理,这是研究较为普遍的模拟酶催化的机理;3)双核金属配合物中的金属离子协同作用机理。 在这3种催化机理中,负责进行亲核进攻的不是配体上的羟基,就是与金属离子相结合而被活化的的氢氧根离子或者水分子,由此可见水溶液或者配体上带有的羟基对催化水解反应起着重要的作用[18]。
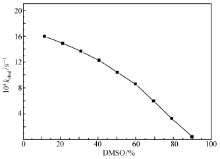 | 图5 不同比例DMSO/水溶剂中Ce (Ⅲ)-BS配合物催化BNPP水解的 kobsd曲线Fig.5 The kobsd curve of BNPP hydrolysis catalyzed by Ce(Ⅲ)-BS complex in different proportions of DMSO/water solvent |
BS的分子结构中有一个单独的氧负原子,为了确定Ce(Ⅲ)-BS体系催化BNPP水解过程中进行亲核进攻的是配体自带的氧负原子,还是与金属离子键合的氢氧根离子,研究了混合溶剂对Ce(Ⅲ)-BS体系催化BNPP水解的影响。 在Ce(Ⅲ)-BS体系水溶液中加入极性有机非质子溶剂二甲亚砜(DMSO),并改变其百分含量,考察它对Ce(Ⅲ)-BS体系催化BNPP水解的影响。
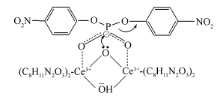
如图5所示,随着混合溶剂中DMSO比例的增加,BNPP水解的速率常数 kobsd不断降低,特别是当DMSO的比例超过50%之后,曲线斜率变大, kobsd下降速度加快。 这说明Ce(Ⅲ)-BS配合物催化BNPP水解过程中遵循的是金属-氢氧根离子机理,进行亲核进攻的是与金属离子键合的氢氧根离子(如Scheme 1所示)。 因此,当混合溶剂中含有大量的DMSO时,溶液中自由的氢氧根离子比例大幅降低,生成具有催化活性的金属-氢氧根离子配合物的趋势减小,导致对BNPP水解的催化效率降低,即表观速率常数降低。
本文比较了BS作为配体的Ce(Ⅲ)配合物催化BNPP水解情况,其中Ce(Ⅲ)-BS体系将速率常数提高了1.52×108倍,效果最好。 通过Job法确定了活性物种中Ce(Ⅲ)与BS的配比是1:2,利用标准钼蓝法对BNPP的水解产物进行了确认,推断出其水解过程。
考察了体系pH值和温度对Ce(Ⅲ)-BS配合物催化BNPP水解的影响。 结果表明,BNPP水解的速率常数 kobsd与pH值的关系图呈“先扬后抑”的曲线, kobsd随着温度的增加而增加,并根据阿伦尼乌斯公式计算了Ce(Ⅲ)-BS体系催化BNPP水解反应的表观活化能为59.24 kJ/mol。 同时研究了混合溶剂对Ce(Ⅲ)-BS体系催化BNPP水解的影响,得知Ce(Ⅲ)-BS体系催化BNPP水解过程中进行亲核进攻的是与金属离子键合的氢氧根离子。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|