研究了芳香醛、乙酰乙酸乙酯和铵盐在水相中的催化Hantzsch反应,探讨了催化剂种类、反应底物比例、反应温度等因素对反应的影响。 最终优化的最佳反应条件为:苯甲醛用量为5 mmol时,0.5 mmol DL-脯氨酸作催化剂,2.5 mmol碳酸铵为氨源,加入10 mL水,于70 ℃条件下反应5 h,收率达90.1%。 催化剂可循环利用,芳香醛底物具有广泛的适用性,产物结构经红外、核磁等技术手段确定。 反应具有环境友好、条件温和、操作简便、产率较高等优点。 结果表明,该水相催化Hantzsch反应具有广泛的适用性。
Aqueous catalytic Hantzsch reaction has been studied with aryl aldehyde, ethyl acetoacetate and ammonium salt. The influences of catalysts, substrate ratio and reaction temperature have been evaluated to optimize the reaction conditions. The optimum reaction conditions were:5 mmol benzaldehyde, 0.5 mmol DL-proline, 2.5 mmol (NH4)2CO3, 10 mL water, reaction time 5 h and reaction temperature 70 ℃. The productivity was 90.1% under the determined optimum reaction conditions. Recycle of catalysts did not show compromise of catalytic activity. The reaction displayed wide scope of aryl aldehyde. All products were confirmed with IR and NMR spectra. Reaction has the advantages of environment friendly, mild conditions, simple operation and high yield. Results show that aqueous catalytic Hantzsch reaction has wide applicability.
Hantzsch反应是多组分合成1,4-二氢吡啶衍生物的经典和有效的方法。 近年来,随着1,4-二氢吡啶衍生物多种生物活性的发现及该类药物的不断问世,1,4-二氢吡啶衍生物具有抗衰老[1]、抗肿瘤[2]、抗糖尿病[3]等生物活性,并且可用于测定苯甲醛[4]等分析应用,Hantzsch反应已成为多组分反应研究的热点[5]。
关于1,4-二氢吡啶类化合物的合成方法,最早是Hantzsch于1882年发明的三组分缩合反应[6],即将干燥氨气通入乙酰乙酸乙酯与醛的乙醇溶液中,该反应时间长、操作复杂,且氨气对环境造成污染。 随后,人们不断地研究并改进合成方法,选用各式各样的催化剂来优化该反应,并取得了一定的成果。 如:微波法[7]、SiO2负载Co催化法[8]、TiO2纳米催化法[9]等。 这些方法对于1,4-二氢吡啶类化合物合成的发展起到了很大的推动作用,也为相关药物中间体的合成提供了更多的选择。 但是这些方法大多是选择较为昂贵或毒害残留较大的催化剂、且存在反应产率不够高等问题,还不太尽如人意,因此寻找和选择更新更绿色的催化剂如脯氨酸[10]、壳聚糖[11]等,甚至是不添加催化剂[12]的方法越来越受到人们的青睐。 本文对芳香醛、乙酰乙酸乙酯和铵盐在水相中的催化Hantzsch反应进行了深入研究,选择绿色、可循环使用的催化剂,提高该反应的产率和适用性。
RE52AA型旋转蒸发器(上海雅荣生化仪器设备有限公司);X-6型显微熔点测定仪(北京中仪博腾科技有限公司);P230II型高效液相色谱仪(大连依利特有限公司);TENSOR-27型红外分析仪(德国Bruker 公司);L6S型紫外可见分光光度计(上海仪电分析仪器有限公司);Bruker Avance 400型核磁共振仪(瑞士Bruker公司)。
苯甲醛、4-氯苯甲醛、对氟苯甲醛、对硝基苯甲醛、3,4-二氯苯甲醛、邻甲氧基苯甲醛、对甲氧基苯甲醛、乙酸铵、碳酸铵、氯化铵、乙酰乙酸乙酯、 DL-脯氨酸、苄基三乙基氯化铵(TEBAC)等均为分析纯;甲醇为色谱纯(上述试剂均购自上海国药集团化学试剂有限公司)。
苯甲醛、乙酰乙酸乙酯、铵盐在催化剂(如TEBAC)的存在下,在水中于70 ℃条件下反应(Scheme 1)。
在三口烧瓶中加入乙酰乙酸乙酯(11.0 mmol,1.4 mL )、一定量的催化剂、10.0 mL水和5.0 mmol铵盐,室温搅拌,直到铵盐完全溶解,用移液管量取重蒸苯甲醛(5.0 mmol,0.5 mL)加入到反应体系中。然后装上冷凝管,搅拌并加热至70 ℃,加热4 h后,将反应混合物放入冰水中冷却。
若冷却后,未出现固体,将反应溶液转入50 mL分液漏斗中,加入5.0 mL乙酸乙酯重复萃取3次,合并萃取液用无水硫酸镁干燥,并旋转蒸发浓缩后加入乙醇重结晶操作,以得到产物。 若冷却后出现固体,将固体进行抽滤,固体用石油醚和水进行洗涤,洗涤数次后,薄层色谱确认洗涤干净,把产品放入烘箱干燥,称重。
2,6-二甲基-4-苯-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 1):白色固体;mp 156.2~158.7 ℃。1H NMR(400 MHz,DMSO-d6), δ:7.31(m,5H,ArH),5.02(s,1H,ArH),4.15(m,4H,2×CH2),2.35(s,6H,2×CH3),1.25(t,6H, J=6.0 Hz,2×CH3);13C NMR(100 MHz,DMSO), δ:167.62,147.76,143.79,128.00,126.07,104.22,59.70,39.66,19.55,14.23;IR(KBr), νmax/cm-1:3343,1689,1661,1307,739;GC-MS(EI)[M]+: m/z计算值C19H23NO4:329.2,理论值329。
2,6-二甲基-4-(4-甲基苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 2):1H NMR(400 MHz,DMSO-d6), δ:1.25(t,6H,2×CH3),2.36(s,6H,2×CH3),2.24(s,3H,—CH3),3.78(s,3H,—OCH3),4.15(q,4H,2×CH2),4.95(s,1H,C—4H),5.74(bs,1H,NH),7.01(d,2H,Ar—H),7.09(d,2H,Ar—H);13C NMR(100 MHz,DMSO), δ:14.38,19.52,22.01,38.72,59.42,102.81,126.96,128.46,132.51,144.12,146.48,167.89。
2,6-二甲基-4-(4-甲氧基苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 3):1H NMR(400 MHz,DMSO-d6), δ:1.21(t,6H,2×CH3),2.29(s,6H,2×CH3),4.10(q,4H,2×CH2),4.99(s,1H,CH),6.07(s,1H,NH),7.10(m,4H,Ar—H),3.62(s,3H,OCH3);13C NMR(400 MHz,DMSO), δ:15.0,20.0,40.3,59.5,104.4,118.8,131.0,131.5,144.4,147.3,166.5。
2,6-二甲基-4-(2-甲氧基苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 4):1H NMR(400 MHz,DMSO-d6), δ:1.23(t,6H,2×CH3),2.33(s,6H,2×CH3),3.94(s,3H,—OCH3),4.14(q,4H,2×CH2),4.84(s,1H,C—4H),5.59(bs,1H,—NH),7.39(m,4H,Ar—H);13C NMR(100 MHz,DMSO), δ:14.18,19.65,35.19,60.79,102.34,121.18,126.22,129.65,131.34,133.39,147.87,150.31,166.89。
2,6-二甲基-4-(4-氯苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 5):1H NMR(400 MHz,DMSO-d6), δ:1.19(t,6H,2×CH3),2.34(s,6H,2×CH3),4.10(q,4H,2×CH2),5.09(s,1H,CH),5.94(s,1H,NH),7.35(m,4H,Ar—H);13C NMR(100 MHz,DMSO), δ:14.6,19.4,39.8,59.4,103.6,119.0,130.4,131.4,144.5,146.6,166.8。
2,6-二甲基-4-(2-氯苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 6):1H NMR(400 MHz,DMSO-d6), δ:1.26(t,6H,2×CH3),2.35(s,6H,2×CH3),4.16(q,4H,2×CH2),4.81(s,1H,C—4H),5.63(bs,1H,—NH),7.39(m,4H,Ar—H);13C NMR(400 MHz,DMSO), δ:14.21,19.69,35.26,61.08,102.50,120.97,125.83,130.07,131.45,133.33,147.92,150.38,167.00。
2,6-二甲基-4-(4-硝基苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 7):1H NMR(400 MHz,DMSO-d6), δ:1.24(t,6H,2×CH3),2.30(s,6H,2×CH3),4. 10(q,4H,2×CH2),4.94(s,1H,C—4H),5.63(bs,1H,—NH),7.42(d,2H,Ar—H),8.05(d,2H,Ar—H);13C NMR(400 MHz,DMSO), δ:14.29,19.70,39.22,59.64,103.61,122.72,126.30,144.92,146.34,150.60,167.47。
2,6-二甲基-4-(3-硝基苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 8):1H NMR(400 MHz,DMSO-d6), δ:1.22(t,6H,2×CH3),2.36(s,6H,2×CH3),4.08(q,4H,2×CH2),5.09(s,1H,CH),5.82(s,1H,NH),7.76(m,4H,Ar—H);13C NMR(400 MHz,DMSO), δ:14.23,19.47,39.96,59.98,103.20,121.3,123.0,128.0,134.52,144.95,148.14,149.99,167.19。
2,6-二甲基-4-(2-硝基苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 9):1H NMR(100 MHz,DMSO-d6), δ:1.21(t,6H,2×CH3),2.35(s,6H,2×CH3),4.11(q,4H,2×CH2),4.82(s,1H,C—4H),5.57(bs,1H,—NH),7.65(m,4H,Ar—H);13C NMR(400 MHz,DMSO), δ:14.20,19.85,35.16,60.70,102.25,121.13,126.17,129.60,131.54,133.48,147.98,150.37,167.27。
2,6-二甲基-2-(4-氟苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 10):1H NMR(400 MHz,DMSO-d6), δ:1.18(t,6H,2×CH3),2.31(s,6H,2×CH3),4.09(m,4H,2×CH2),5.24(s,1H,C—4H),5.68(bs. 1H,—NH),7.01(d,2H,Ar—H),7.28(d,2H,Ar—H);13C NMR(100 MHz,DMSO), δ:14.21,19.70,35.21,61.01,102.30,121.07,125.93,130.02,131.41,133.43,147.90,150.35,167.10。
2,6-二甲基-4-(4-溴苯)-1,4-二氢吡啶-3,5-二羧酸二甲酯(表5,Entry 11):1H NMR(400 MHz,DMSO-d6), δ:1.18(t,6H,2×CH3),2.28(s,6H,2×CH3),4.10(q,4H,2×CH2),4.91(s,1H,C—4H),5.46(bs,1H,—NH),7.09(d,2H,Ar—H),7.25(d,2H,Ar—H);13C NMR(400 MHz,DMSO), δ:14.17,19.69,39.18,59.81,103.82,127.92,129.36,131.39,143.10,146.29,167.68。
2.1.1 催化剂对产率的影响 以苯甲醛、乙酰乙酸乙酯、醋酸铵的Hantzsch反应考察不同催化剂(10.0%摩尔分数)对产率的影响,实验结果见表1,其中各组产品经乙醇多次重结晶,纯度一般可达99.0%以上。 从表1可见,在选用的各种催化剂中,在相同的反应条件下,以 D/L-脯氨酸的催化产率最高,可达到57.1%,其次是TEBAC,产率为50.0%,其它的催化剂的催化产率较低,因此后续实验采用 DL-脯氨酸作为催化剂。
| 表1 催化剂对产率的影响 Table 1 The effect of catalyst on the yield |
2.1.2 铵源对产率的影响 考虑到用NH4OAc作为铵源的产率较低,且难以析出固体,选择(NH4)2CO3、NH4HCO3、NH4Cl和(NH4)2SO4作为铵源做了对比实验,实验结果见表2。 在相同的反应条件下,(NH4)2CO3作为铵源,反应产率比NH4OAc高很多,且在反应4 h左右即可析出白色固体,而NH4Cl和(NH4)2SO4为铵盐基本没有反应,因此后续实验选用(NH4)2CO3作为铵源。 同时发现,(NH4)2CO3的用量为苯甲醛的0.5倍(摩尔比)时,反应获得了最高的收率85.6%,(NH4)2CO3的用量增加时,收率下降。
| 表2 铵源对产率的影响 Table 2 The effect of ammonium salt on the yield |
2.1.3 催化剂条件对产率的影响 在上述优化的条件下,考察催化剂用量、反应温度和反应时间对产率的影响,实验结果见表3。 不加催化剂时产率只有40.6%,当催化剂用量为苯甲醛用量的10.0%(摩尔分数)时,其催化效果最佳,收率达到85.6%,所以本实验采用苯甲醛用量10.0%摩尔分数的催化剂量来进行实验。
反应温度对产率有明显的影响,产率随温度的升高而增加,70 ℃时达到最高,而随着温度的继续升高,产率反而降低,这主要是因为温度过高,(NH4)2CO3分解升华。 因此,本实验选用70 ℃作为最佳反应温度。在该反应温度下,反应时间在5 h时的产率最高,反应时间过短或过长,它的产率均会降低。
| 表3 催化条件对产率的影响 Table 3 The effect of catalytic condition on the yield |
2.1.4 用水量对产率的影响 考察溶剂(水)的不同用量对产率的影响,实验结果见表4。 水的用量对反应有较明显的影响。 在无溶剂条件下产率较低,主要是因为(NH4)2CO3受热分解升华,降低了氨的反应浓度,使反应不完全。 当水的用量在10.0 mL时,产率最高,当用水量增加以后,反应产率降低,因此,本实验选用10.0 mL水作为溶剂。
| 表4 用量水对产率的影响 Table 4 The effect of amount of water on the yield |
基于上述反应条件的优化,使用不同的芳香醛代替苯甲醛,考察该水相的Hantzsh反应的适用性,实验结果见表5。 结果表明,该方法有较好的普适性,且发现当苯环上有吸电子基时,产率要比供电子基好,如用对硝基苯甲醛为底物时,产率为87.7%,用间硝基苯甲醛为底物时,产率为89.2%;而用对甲氧基苯甲醛为底物时,产率仅为66.7%,以邻甲氧基取代苯甲醛为底物时,产率为77.7%。
| 表5 底物种类对产率的影响 Table 5 The effect of substrate type on the yield |
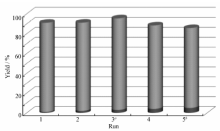
2.1.7 催化剂循环实验 考察催化剂的可重用性,在以苯甲醛为底物的反应结束后,将产物经结晶收集后,剩余水相经萃取分离除去脂溶性物质,剩余的水相中加入苯甲醛、乙酰乙酸乙酯、碳酸铵继续反应,结果如图1所示。 可见催化剂的可重用性较好,重复使用中产率比较稳定。 其中第三次重用前没有经过萃取操作,仍然保持了很高的催化效率,收率可以达到92.5%。 该催化体系具有较好的循环使用性能。
Hantzsch反应是合成二氢吡啶的有效方法。 本文研究了水相中的Hantzsch反应,通过考察催化剂、铵盐、底物比例等对反应收率的影响,获得最优反应条件,收率达到90.1%,反应具有广泛的底物适用性,催化体系可重用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|