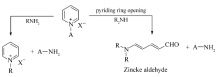
吡啶季铵盐的开环是有机合成中的一个重要的多步串联反应,应用领域广阔。 但目前对其开环机理尚存一些争议。 基于开环前后,其分子共轭结构的差异,利用紫外光谱对吡啶季铵盐的开环反应过程进行了研究,并对形成其关键中间体1-苯胺基-5-苯亚胺基-1,3-戊二烯的影响因素进行了优化。 此外,将超声辐射引入吡啶季铵盐的开环过程,提升了开环的效率,开环速率提高了94%。
The ring-opening of pyridinium salt is an important multi-step tandem reaction, which have wide application in organic synthesis. However, principle of the ring-opening process partly remains some controversy. In this paper, based on the difference in molecular conjugate structure before and after ring-opening reaction, the principle of ring-opening of pyridinium salt was studied by ultraviolet spectrum. Meanwhile, the factors influenced the formation of N-(5-anilino-2,4-pentadienylidene)aniline hydrochloride was evaluated in detail. Furthermore,ultrasonic radiation was introduced in the ring-opening reaction of pyridinnium salt and the efficiency of the ring-opening was improved for 94%.
吡啶季铵盐是一类重要的有机合成中间体。 由于吡啶环的芳香性、碱性以及吸电子效应,使其具有很丰富的化学性质[1,2]。 其中,吡啶季铵盐的开环反应应用最为广泛,能够巧妙地用于合成新的化合物,例如Zincke反应[3],即吡啶季铵盐与伯胺反应时生成另外一种吡啶季铵盐的反应,吡啶季铵盐与仲胺反应时则发生开环反应,得到Zincke醛[4](Scheme 1)。
目前关于吡啶季铵盐开环反应机理尚存有一定的争议。 Yamaguchi等[5]报道利用吡啶季铵盐与伯胺进行开环反应首先生成1,7-取代二氮杂环十二轮烯衍生物,但Manfred Christl[6]通过图谱分析提出质疑,认为轮烯的结构并不能确定(Scheme 2)。
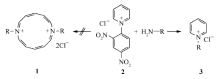 | Scheme 2 Plausible reaction mechanism of N-(2,4-dinitrophenyl) pyridinium chloride with primary amine |
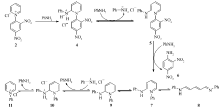
目前,广泛接受的吡啶季铵盐与伯胺的反应过程,中间经过了一系列的开环与再环化的过程[7](Scheme 3)。 在此系列反应过程中,开环产物1-胺基-5-亚胺基-1,3-戊二烯(8)是一个重要的中间体[8,9],在很多合成领域有着广泛的应用,例如它是合成医学造影剂吲哚菁绿的重要原料之一,目前的报道中均是在加热回流的状态下合成[10]。 但本文研究中发现,此反应条件下的产物收率很低,难以分离。 因此,本文基于吡啶季铵盐开环反应前后,分子共轭结构的巨大差异,以氯化1-(2,4-二硝基苯基)吡啶鎓盐(2)与苯胺为原料,以开环关键中间体1-苯胺基-5-苯亚胺基-1,3-戊二烯(8)为对象,通过紫外光谱研究了其开环过程。 并对1-苯胺基-5-苯亚胺基-1,3-戊二烯(8)的合成过程进行了优化。 在此基础上,本文将超声辐射引入开环过程,提升了开环效率。
Bruker Avance 300型核磁共振仪(德国Bruker公司),以四甲基硅为内标;Shimadzu 3150-PC型紫外分光光度计(UV-Vis,日本岛津公司);KH3200B型超声波清洗器(昆山禾创超声仪器有限公司);HH-2型恒温水浴锅(国华电器有限公司)。 吡啶、2,4-二硝基氯苯、苯胺购自阿拉丁试剂公司,所有试剂均为分析纯。
1.2.1 氯化1-(2,4-二硝基苯基)吡啶季铵盐(2)的制备 在250 mL的单口烧瓶中加入溶剂100 mL无水乙醇,2,4-二硝基氯苯20.25 g(0.10 mol)以及吡啶10 mL(0.12 mol),80 ℃下搅拌回流反应2 h。 旋转蒸发除去溶剂,粗产物用丙酮洗涤,甲醇重结晶得淡黄色固体27 g,产率92.50%,mp 189~190 ℃(文献值[11]186~189 ℃)。1H NMR(300 MHz,DMSO-d6), δ:8.45(t,3H, J=11.70 Hz,CH),8.97(t, 2H, J=8.4 Hz,CH),9.12(s,1H,CH),9.45(s,2H,CH)。
1.2.2 1-苯胺基-5-苯亚胺基-1,3-戊二烯(3)的制备 在250 mL三颈烧瓶中加入氯化1-(2,4-二硝基苯基)吡啶季铵盐7.04 g(0.025 mol)和苯胺5.4 mL(0.058 mol)和50 mL无水乙醇,加热回流0.5 h,冷却后,加入50 mL水,过滤,滤饼用丙酮洗涤,干燥后得棕红色固体3.42 g,收率48%,mp 135~137 ℃(文献值[11]mp 139~140 ℃)。1H NMR(500 MHz,DMSO-d6), δ:6.39(t,2H, J=11.80 Hz,CH),7.22(s,2H,CH),7.46(m, 8H, J=7.15 Hz,CH),7.86(t,1H, J=10.65 Hz,CH),8.57(s,2H,CH),12.22(s,2H,NH·HCl)。
1.2.3 基于紫外光谱的氯化1-(2,4-二硝基苯基)吡啶的开环研究 改变原料摩尔比、溶剂极性、温度,分别称取10份不同反应原料氯化1-(2,4-二硝基苯基)吡啶鎓盐(2)和苯胺,稀释到相同的摩尔数2.36 mg/L,通过紫外光谱对反应进行监控。 具体条件如表1所示。
1.2.4 超声辐射促进的吡啶季铵盐开环反应 取0.71 g(2.50 mmol)的化合物2,0.53 mL(5.75 mmol)的苯胺溶于30mL的乙醇中,在超声辐射下反应2 h,超声功率150 W,控制温度为常温,采用紫外光谱监控。
| 表1 开环的不同反应条件 Table 1 Different reaction conditions for ring opening |
N-2,4-二硝基苯基吡啶盐(2)与一分子苯胺共同加热时,苯胺与吡啶芳环发生亲核加成,引发吡啶开环。 开环的中间体继续与苯胺作用,放出2,4-二硝基苯胺(6),化合物6的紫外的最大特征峰在345 nm左右。 同时生成反-顺-反式(7)或者反-反-反式(8)结构的1-苯胺基-5-苯亚胺基-1,3-戊二烯,这是一个共轭链增长的结构,经紫外检测,其最大特征吸收峰在480 nm处。 反-顺-反式异构体可以通过 或自身兼性离子的亲核加成,生成环化的中间体,然后发生质子化与消除反应,最终得到新的吡啶盐(11),其最大特征吸收峰在260 nm左右。
2.2.1 投料比的影响 本文首先研究了投料比对反应的影响,改变吡啶盐与苯胺的比例,测量一段时间内反应体系紫外光谱的变化,如图1所示。 结果表明,在前120 min以内,随着苯胺量的增加,480 nm处吸收峰的强度也随之增加,当氯化1-(2,4-二硝基苯基)吡啶鎓盐(2):苯胺的比例从1::1增加到1:3时, 480 nm处吸收峰的强度从0.34增加到1.01。 但随着反应时间进一步延长,原料比例为1:3的反应体系特征峰的强度却开始降低,720 min之后,吸收峰强度下降到0.73,但345 nm附近的吸收峰依然有所增加,如图1 D所示(图中左上角插图代表480 nm处的吸光度-时间曲线,下同)。
 | 图1 原料化合物2与苯胺摩尔比例对反应体系紫外光谱的影响(20 ℃)Fig.1 Impact of the molar ratio of N-(2,4-dinitrophenyl) pyridinium chloride with aniline on UV-Vis spectra(20 ℃) |
因为此反应是串联过程,由机理图可知,化合物9 转变为化合物10是直接推动开环体再环化的一步反应。 但在反应初始阶段,化合物9的浓度相对较小,因此反应速率较低,对开环产物的再环化推动较慢,但随着反应时间的延长,化合物9的浓度增加,此时随着苯胺浓度的增加,苯胺盐酸盐的浓度增加,化合物9向化合物10的转化加快。 从而推动化合物7的再环化过程加快,导致480 nm处吸收峰强度的降低。
2.2.2 溶剂极性的影响 溶剂的极性对开环反应也有重要的影响。 本文通过改变乙醇与水的配比来改变反应溶剂的极性,测量一段时间内其紫外光谱的变化。 其它反应条件如表1中Entries 4~7所示。 研究结果表明,随着溶剂极性的降低, N-2,4-二硝基苯基吡啶盐(2)的开环速率增加,如图2所示。 当采用20%的乙醇水溶液为溶剂,反应时间为5 min时,其480 nm处的吸收峰强度为0.011,反应时间延长到720 min之后,其吸收强度增加到0.097。 但随着溶剂中乙醇的含量增加,开环速率明显增加。 当乙醇含量为80%时,反应时间从5 min延长到720 min,480 nm处的吸收峰强度从0.12 增加到1.22。 根据实验结果,本文分析认为,当吡啶季铵盐发生开环后,共轭结构极性降低,溶剂极性的降低有利于其稳定性的提高,因此开环速率增加。
 | 图2 溶剂极性对反应体系紫外光谱的影响(20 ℃)(插图为480 nm 处吸收峰随时间变化紫外图)Fig.2 Impact of solvent polarity on UV-Vis spectra of reaction system(20 ℃)(Inset:the change of ultraviolet absorption at 480 nm over time) |
2.2.3 温度的影响 目前,大部分的文献[10,11]报道合成1-苯胺基-5-苯亚胺基-1,3-戊二烯(8)时,反应体系保持回流状态。 但本文研究发现,回流状态不利于其收率的提高,如图3所示。 在回流状态下,反应5 min后,480 nm处的特征峰即达到最高值,约为0.63。 但随着时间的延长,480 nm处吸收峰的高度逐渐下降,60 min之后,从0.55 降到0.089,之后峰高度衰减明显加快,720 min之后几乎完全消失,但345 nm附近的吸收峰有所增强,如图3 D所示。 但在常温下,5 min之后480 nm处的吸收峰高度为0.12,随着反应时间的延长,其高度持续增加,720 min之后,增加到1.24,345 nm附近的吸收峰也同步增加,如图3 A所示。 当反应温度升高到40℃,在120 min之后,480 nm处的吸收峰高度达到最大值,在1.35左右。 之后基本不再变化,当温度进一步增加达到60 ℃时,60 min之后,480 nm附近的吸收峰达到最大值,为1.49,之后开始下降,720 min 之后降低到0.012,如图3 B, C所示。
 | 图3 反应温度对反应体系紫外光谱的影响(插图为480 nm 处吸收峰随时间变化紫外图)Fig.3 Impact of temperature on UV spectra of reaction system(Inset:the change of ultraviolet absorption at 480 nm over time) |
本文的研究结果表明,1-苯胺基-5-苯亚胺基-1,3-戊二烯(8)合成的最佳温度在60 ℃左右。 综上实验结果,温度过高或者时间过长,不利于目标产物8的生成,由于化合物7转变为化合物9,分子共轭程度有所降低,而化合物7转变为化合物8,只是构象转变的过程,从有机原理而言,活化能较低。 因此,温度的增加,对于化合物7的再环化过程影响更大。 随着温度的升高,再环化过程的相对速率加快。 导致一段时间之后,开环中间体的吸收峰发生明显衰减。
基于课题组前期工作的积累[12],本文进一步研究了超声对于氯化1-(2,4-二硝基苯基)吡啶季铵盐(2)开环的影响。 实验结果显示,在常温下,超声辐射能极大地提升开环反应的效率,如图4所示。 在常温无超声辅助下,120 min之后,480 nm处的吸收峰高度为0.79,但在超声作用下,120 min之后,吸收峰高度增加到1.53,同比开环速率提高了94%。 本文研究分析认为,由于实验过程中控制温度,所以超声作用导致体系温度升高从而促进开环速率的影响相对较小,吡啶季铵盐前期的开环反应是分子间的作用过程,而再环化是分子内的反应。 超声波的“空化”作用主要是提升分子碰撞的几率与能量,因此对开环过程更有利。
通过紫外光谱研究了氯化1-(2,4-二硝基苯基)吡啶季铵盐(2)的开环反应。 研究结果表明,当苯胺的量过多时并不利于目标产物的生成。 同时,吡啶季铵盐发生开环后,共轭结构极性降低,溶剂极性的降低有利于其稳定性的提高,因此开环速率增加。 其次,温度的升高,更有利于1-苯胺基-5-苯亚胺基-1,3-戊二烯的再环化过程。 此外,超声辐射有利于吡啶的开环反应,能够提高反应的速率。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|