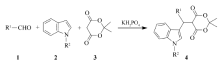
以醛、吲哚和麦氏酸为原料,水和乙醇混合液为溶剂,在室温搅拌条件下以磷酸二氢钾为催化剂通过Yonemitsu缩合反应,合成了一系列的5-[(3-吲哚基)-芳甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮衍生物,产率为48%~98%,并通过X射线单晶衍射仪测定了化合物4o的晶体结构。 该方法能够有效的促使反应活性较低的4-甲基苯甲醛和4-甲氧基苯甲醛参与反应,以83%和60%的收率获得相应的目标产物,并具有反应条件温和、催化剂廉价易得、后处理简单、产物易于纯化、产率较高等优点,可用于合成3-取代吲哚类化合物。
A simple and efficient procedure for the preparation of 5-[(indol-3-yl)-arylmethyl]-2,2-dimethyl-1,3-dioxane-4,6-dione derivatives has been developed through the Yonemitsu condensation of indole with Meldrum's acid and aldehyde in the mixed solvent of ethanol and water at room temperature using KH2PO4 as an inexpensive, commercially available, and efficient catalyst. The crystal structure of compound 4o was confirmed by X-ray diffraction. This method has the advantages of mild reaction conditions, tolerance to diverse functional groups such as 4-methyl benzaldehyde and 4-methoxy benzaldehyde, and good to excellent yields(48%~98%). Furthermore, some of the products can be facilely obtained by vacuum filtration without further purification. This strategy provides an alternative approach for easy access to useful synthetic β-indole derivatives.
与传统的分步进行的有机合成方法相比,多组分反应具有操作简单、分离和纯化步骤少、高选择性和原子经济性等特点,可以实现简便、高效、大量地合成具有结构多样性、复杂性的化合物。 目前,无论在基础化学还是在化学工业领域,随着新材料、医药、诊断试剂、农药以及天然产物及其衍生物等生物活性物质的研究进展,多组分反应的研究取得了飞速的发展,已经涉及到有机化学、应用化学、医药及材料科学的各个领域[1,2,3,4]。
吲哚骨架是广泛存在于天然产物和药物分子中的重要结构单元[5,6,7],由于它与许多受体之间存在较强的亲和力[8],被认为是“优势结构”[5,9,10]。 目前,吲哚化学的研究不仅在杂环化学中占有重要地位,而且在材料科学、农药化学、药剂学等研究领域中也有着广泛的应用[11,12]。 发展含有吲哚骨架的复杂分子合成策略一直是有机化学及药物化学的研究热点[7]。 3-取代吲哚衍生物就是其中很重要的一种,其本身就是一类具有药理活性的杂环化合物[13],也是合成3-吲哚丙酸酯[14]、各种 β-取代的色氨酸、各种 β-咔啉和咔唑及抗肿瘤药物的重要中间体[15,16],已用于构筑许多重要天然产物和相应具有生物活性化合物的骨架。 因此,发展新型、高效、高选择性地合成3-取代吲哚衍生物方法的研究格外引人注目,有关于这方面的报道剧增[17]。 由醛、2,2-二甲基-1,3-二噁烷-4,6-二酮(麦氏酸)和吲哚发生的三组分Yonemitsu缩合反应,是有效地合成该类化合物的方法之一[18,19]。 近年来,报道了许多催化体系可以促进Yonemitsu缩合反应,如Proline[14,15,16,20,21,22]、TiCl4/Et3N[18,19]、Yb(OTf
XT-5型数字熔点仪(北京泰克仪器有限公司);Bruker TENSOR 27型红外光谱仪测定(德国Bruker公司),KBr压片;Bruker Avance III 400 MHz型核磁共振仪测定(德国Bruker公司),DMSO-d6为溶剂,TMS为内标;Bruker Daltonics micro TOF-QII型高分辩质谱仪(德国Bruker公司);Bruker Smart APEX Ⅱ型单晶X射线衍射仪(德国Bruker公司)。 实验中使用的药品和试剂皆为市售分析纯试剂。
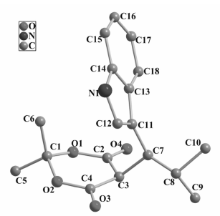
目标化合物4a~4s的合成:向10 mL反应管中加入吲哚0.0593 g或1-甲基吲哚0.0665 g(0.5 mmol)、麦氏酸0.0721 g(0.5 mmol)、KH2PO4 0.0068 g(10%摩尔分数,以吲哚摩尔数为计)、乙醇1.7 mL和水0.3 mL,室温下搅拌至固体完全溶解后加入醛(0.55 mmol),继续搅拌6~10 h。 反应结束后大部分产物为固体,向反应体系中加入1 mL 95%乙醇,搅拌片刻后直接抽滤,滤饼用适量冷的95%乙醇淋洗,抽干后得到相应的纯净产物4,其中产物4c、4d、4i、4n、4o、4r、4s等需要重结晶。 所得化合物结构经 IR、HRMS、NMR等确认,通过X射线单晶衍射测定了化合物4o的晶体结构(CCDC NO.1055621),化合物结构分析数据如下:
5-[(3-吲哚基)-苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4a)[28]:白色固体。 IR(KBr), σ/cm-1:3403,3052,2955,2946,1779,1747,1497,1456,1389,1293;1H NMR(400 MHz,DMSO-d6), δ:1.54(s,3H),1.82(s,3H),5.24(d, J=4 Hz,1H),5.41(d, J=4 Hz,1H),6.87(t, J=8 Hz,1H),7.03(t, J=8 Hz,1H),7.15~7.25(m,5H),7.30(d, J=8 Hz,2H),7.36(d, J=8 Hz,1H),11.02(s,1H,NH)。
5-[(3-吲哚基)-4-甲基苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4b)[25]:白色固体。 IR(KBr), σ/cm-1:3428,3068,3003,2918,2858,1772,1740,1579,1388,1302;1H NMR(400 MHz,DMSO-d6), δ:1.53(s,3H),1.81,(s,3H),2.23(s,3H),5.20(d, J=4 Hz,1H),5.37(s,1H),6.86(t, J=8 Hz,1H),7.02(t, J=8 Hz,3H),7.15~7.21(m,4H),7.35(d, J=8 Hz,1H),11.00(s,1H,NH)。
5-[(3-吲哚基)-3-甲基苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4c):白色固体。 IR(KBr), σ/cm-1:3405,3015,2931,2864,1742,1603,1390,1312;1H NMR(400 MHz,DMSO-d6), δ:1.52(s,3H),1.81,(s,3H),2.22(s,3H),5.20(d, J=4 Hz,1H),5.37(d, J=4 Hz,1H),6.87(t, J=8 Hz,1H),6.98(d, J=8 Hz,1H),7.03~7.15(m,4H),7.19(d, J=8 Hz,2H),7.35(d, J=8 Hz,1H),11.00(s,1H,NH);13C NMR(100 MHz,DMSO-d6), δ:21.14,26.79,27.67,51.68,104.91,111.39,113.24,118.44,118.50,121.07,123.93,125.99,127.03,127.62,129.35,135.72,136.60,141.13,165.05,165.55;HRMS(ESI-MS)计算值C22H22NO4[M+H]+:364.1543,实测值364.1553。
5-[(3-吲哚基)-4-甲氧基苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4d)[16]:黄色固体。 IR(KBr), σ/cm-1:3434,3052,3003,2899,2835,1779,1734,1574,1515,1301;1H NMR(400 MHz,DMSO-d6), δ:1.53(s,3H),1.81(s,3H),3.69(s,3H),5.18(s,1H),5.36(s,1H),6.78(d, J=8 Hz,2H),6.86(t, J=8 Hz,1H),7.02(t, J=8 Hz,1H),7.13(d, J=8 Hz,1H),7.20(d, J=8 Hz,3H),7.35(d, J=8 Hz,1H),11.00(s,1H,NH)。
5-[(3-吲哚基)-3-甲氧基苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4e):乳白色固体。 IR(KBr), σ/cm-1:3428,3065,3019,2944,2874,1785,1746,1588,1491,1456,1333,1298;1H NMR(400 MHz,DMSO-d6), δ:1.54(s,3H),1.82(s,3H),3.66(s,3H),5.24(d, J=4 Hz,1H),5.40(s,1H),6.74(d, J=8 Hz,1H),6.87~6.92(m,3H),7.04(t, J=8 Hz,1H),7.13(t, J=8 Hz,1H),7.22(d, J=8 Hz,2H),7.37(d, J=8 Hz,1H),11.02(s,1H,NH);13C NMR(100 MHz,DMSO-d6), δ:26.73,27.68,51.70,54.82,104.94,111.06,111.41,113.08,115.22,118.49,118.53,121.15,123.88,127.06,128.71,135.74,142.83,158.79,165.04,165.51;HRMS(ESI-MS)计算值C22H22NO5[M+H]+:380.1492,实测值380.1496。
5-[(3-吲哚基)-2-甲氧基苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4f):白色固体。 IR(KBr), σ/cm-1:3408,3046,2989,2880,1779,1741,1487,1460,1308;1H NMR(400 MHz,DMSO-d6), δ:1.61(s,3H),1.77(s,3H),3.86(s,3H),4.84(d, J=4 Hz,1H),5.61(d, J=4 Hz,1H),6.71(t, J=8 Hz,1H),6.88~6.94(m,2H),6.97(d, J=8 Hz,1H),7.04(t, J=8 Hz,1H),7.14~7.20(m,3H),7.37(d, J=8 Hz,1H),11.03(s,1H,NH);13C NMR(100 MHz,DMSO-d6), δ:27.17,27.67,35.18,49.69,55.20,104.75,110.10,111.44,113.36,118.38,118.50,119.59,121.22,123.68,126.97,127.58,128.74,130.80,135.82,156.21,165.34,165.66;HRMS(ESI-MS)计算值C22H22NO5[M+H]+:380.1492,实测值380.1498。
5-[(3-吲哚基)-4-氯苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4g)[28]:淡粉色固体。 IR(KBr), σ/cm-1:3434,3058,2996,2867,1771,1740,1574,1490,1300;1H NMR(400 MHz,DMSO-d6), δ:1.59(s,3H),1.84(s,3H),5.30(d, J=4 Hz,1H),5.39(d, J=4 Hz,1H),6.88(t, J=8 Hz,1H),7.04(t, J=8 Hz,1H),7.16(d, J=8 Hz,2H),7.28~7.34(m,4H),7.36(d, J=8 Hz,1H),11.06(s,1H,NH)。
5-[(3-吲哚基)-3-氯苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4h)[22]:黄色固体。 IR(KBr), σ/cm-1:3447,3078,3003,2945,2872,1785,1741,1574,1466,1325,1300;1H NMR(400 MHz,DMSO-d6), δ:1.60(s,3H),1.85(s,3H),5.34(d, J=4 Hz,1H),5.41(d, J=4 Hz,1H),6.91(t, J=8 Hz,1H),7.07(t, J=8 Hz,1H),7.18~7.29(m,5H),7.36~7.39(m,2H),11.08(s,1H,NH)。
5-[(3-吲哚基)-2-氯苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4i):淡粉色固体。 IR(KBr), σ/cm-1:3422,3049,2995,2945,2887,1776,1746,1570,1460,1399,1307;1H NMR(400 MHz,DMSO-d6), δ:1.64(s,3H),1.82(s,3H),4.97(t, J=4 Hz,1H),5.78(t, J=4 Hz,1H),6.88(t, J=8 Hz,1H),7.02~7.27(m,5H),7.35~7.40(m,2H),7.46(d, J=8 Hz,1H),11.08(s,1H,NH);13C NMR(100 MHz,DMSO-d6), δ:26.92,27.69,37.92,49.13,105.23,111.54,112.04,118.19,118.69,121.39,123.23,126.38,126.68,128.31,128.85,132.49,132.98,135.81,138.47,164.90,165.29;HRMS(ESI-MS)计算值C21H19ClNO4[M+H]+:384.0997,实测值384.1009。
5-[(3-吲哚基)-4-溴苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4j)[16]:淡粉色固体。 IR(KBr), σ/cm-1:3431,3059,2997,2869,1776,1741,1583,1487,1390,1303;1H NMR(400 MHz,DMSO-d6), δ:1.59(s,3H),1.84(s,3H),5.30(d, J=4 Hz,1H),5.39(s,1H),6.88(t, J=8 Hz,1H),7.04(t, J=8 Hz,1H),7.18(d, J=8 Hz,2H),7.26(d, J=8 Hz,2H),7.37~7.44(m,3H),11.06(s,1H,NH)。
5-[(3-吲哚基)-3-溴苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4k):淡粉色固体。 IR(KBr), σ/cm-1:3444,3076,2992,2869,1759,1642,1575,1463,1390,1307;1H NMR(400 MHz,DMSO-d6), δ:1.60(s,3H),1.85(s,3H),5.33(d, J=4 Hz,1H),5.40(s,1H),6.89(t, J=8 Hz,1H),7.05(t, J=8 Hz,1H),7.18~7.23(m,3H),7.32~7.39(m,3H),7.50(s,1H),11.06(s,1H,NH);13C NMR(100 MHz,DMSO-d6), δ:26.55,27.67,51.57,105.10,111.49,112.33,118.46,118.63,121.09,121.29,123.67,126.91,128.00,129.12,129.80,131.55,135.74,144.27,164.84,165.30;HRMS(ESI-MS)计算值C21H19BrNO4[M+H]+:428.0492,实测值428.0500。
5-[(3-吲哚基)-4-硝基苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4l)[28]:黄色固体。 IR(KBr), σ/cm-1:3410,3326,3071,3007,2901,2872,1781,1743,1603,1518,1353,1302;1H NMR(400 MHz,DMSO-d6), δ:1.63(s,3H),1.87(s,3H),5.45(d, J=4 Hz,1H),5.52(s,1H),6.90(t, J=8 Hz,1H),7.06(t, J=8 Hz,1H),7.19(t, J=8 Hz,2H),7.38(d, J=8 Hz,1H),7.58(d, J=8 Hz,2H),8.12(d, J=8 Hz,2H),11.13(s,1H,NH)。
5-[(3-吲哚基)-3-硝基苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4m)[28]:黄色固体。 IR(KBr), σ/cm-1:3434,3078,3003,2872,1772,1743,1574,1524,1347,1301;1H NMR(400 MHz,DMSO-d6), δ:1.63(s,3H),1.87(s,3H),5.46(d, J=4 Hz,1H),5.54(d, J=4 Hz,1H),6.90(t, J=8 Hz,1H),7.06(t, J=8 Hz,1H),7.22~7.25(m,2H),7.39(d, J=8 Hz,1H),7.53(t, J=8 Hz,1H),7.80(d, J=8 Hz,1H),8.05(d, J=8 Hz,1H),8.24(s,1H),11.13(s,1H,NH)。
5-[(3-吲哚基)-4-氟苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4n):白色固体。 IR(KBr), σ/cm-1:3406,3069,3009,2892,1754,1592,1502,1396,1307;1H NMR(400 MHz,DMSO-d6), δ:1.57(s,3H),1.83(s,3H),5.26(s,1H),5.41(s,1H),6.87(t, J=8 Hz,1H),7.04(t, J=8 Hz,3H),7.16~7.21(m,2H),7.33~7.38(m,3H),11.03(s,1H,NH);13C NMR(100 MHz,DMSO-d6), δ:26.63,27.68,51.66,104.99,111.43,113.07,114.23,114.44,118.50,121.17,123.74,126.88,130.78,130.86,135.82,137.30,159.57,161.98,164.88,165.45;HRMS(ESI-MS)计算值C21H19FNO4[M+H]+:368.1293,实测值368.1302。
5-[(3-吲哚基)-2-甲基丙基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4o)[25]:白色固体。 IR(KBr), σ/cm-1:3387,3059,2973,2901,2867,1766,1723,1543,1454,1306;1H NMR(400 MHz,DMSO-d6), δ:0.68(d, J=8 Hz,3H),1.13(d, J=8 Hz,6H),1.65(s,3H),2.59~2.68(m,1H),3.51(dd, J=4,8 Hz,1H),4.50(d, J=4 Hz,1H),6.94(t, J=8 Hz,1H),7.02~7.06(m,2H),7.30(d, J=8 Hz,1H),7.50(d, J=8 Hz,1H),10.95(s,1H)。
5-[3-(1-甲基吲哚基)-苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4r):淡粉色固体。 IR(KBr), σ/cm-1:3077,3054,2931,2873,1778,1753,1572,1480,1389,1319,1285;1H NMR(400 MHz,DMSO-d6), δ:1.55(s,3H),1.82(s,3H),3.79(s,3H),5.24(d, J=4 Hz,1H),5.41(d, J=4 Hz,1H),6.91(t, J=8 Hz,1H),7.10(t, J=8 Hz,1H),7.17~7.25(m,5H),7.31(d, J=8 Hz,2H),7.36(d, J=8 Hz,1H);13C NMR(100 MHz,DMSO-d6), δ:26.64,27.68,32.44,51.65,104.98,109.59,112.53,118.59,118.70,121.22,126.28,127.38,127.73,128.28,128.80,136.16,141.09,164.96,165.35;HRMS(ESI-MS)计算值C22H22NO4[M+H]+:364.1543,实测值364.1540。
5-[3-(1-甲基吲哚基)-4-硝基苯甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮(4s):黄色固体。 IR(KBr), σ/cm-1:3067,3010,2941,2881,1779,1743,1591,1514,1350,1321,1204;1H NMR(400 MHz,DMSO-d6), δ:1.64(s,3H),1.87(s,3H),3.81(s,3H),5.45(d, J=4 Hz,1H),5.50(d, J=4 Hz,1H),6.94(t, J=8 Hz,1H),7.13~7.19(m,2H),7.25(d, J=8 Hz,1H),7.41(d, J=8 Hz,1H),7.59(d, J=8 Hz,2H),8.11(d, J=8 Hz,2H);13C NMR(100 MHz,DMSO-d6), δ:26.38,27.67,32.50,51.44,106.30,109.76,111.23,118.62,118.87,121.50,122.78,127.27,127.98,130.08,136.21,145.94,149.62,164.02,165.03;HRMS(ESI-MS)计算值C22H21N2O6[M+H]+:409.1394,实测值409.1400。
以0.5 mmol苯甲醛、0.5 mmol吲哚和0.5 mmol麦氏酸的三组分反应为模型反应,分别考察溶剂、催化剂及其用量、反应时间和反应温度等因素对反应结果的影响,结果见表1。 水相中KH2PO4可促进反应较快的进行,但反应过程中生成的沉淀易结块,并有粉色杂质生成,产物需重结晶提纯(表1,Entry 1);而在乙醇中进行三组分反应,不仅产率有所提高,而且产生的白色沉淀过滤后不需进一步提纯,但反应速率慢于水相中的反应(表1,Entry 2)。 随后,以乙醇为溶剂,考察了几种常见的Lewis酸和Brønsted酸对反应的影响(表1,Entries 3~10),酸性较强的对甲苯磺酸对反应不利,在这几种催化剂中,Cu(OAc)2和KH2PO4的催化效果最好(表1,Entry 2和Entry 3)。 我们又考察了与KH2PO4类似的KHSO4和K2HPO4的催化效果,使用KHSO4时反应体系变成红色透明溶液,没有产物沉淀生成,原因可能是硫酸氢盐在乙醇中分解(表1,Entry 9);以K2HPO4为催化剂时产物产率降低(表1,Entry 10)。 KH2PO4廉价易得、催化活性高,因此,选择其为反应催化剂,并继续考察温度和反应时间对反应的影响(表1,Entries 11~14)。 结果表明,最佳反应温度为20 ℃,升高反应温度,反应结果没有明显改善,降低反应温度到0 ℃,产物的产率有较大程度的下降;最佳反应时间为6 h,缩短反应时间会使产率降低。为兼顾反应速率和产物的纯度,考虑使用混合溶剂为反应介质,实验显示,向乙醇中加入极性较大的水可改善催化剂的溶解性,提高反应活性(表1,Entry 15)。 调整混合液中乙醇与水的比例和溶液的体积对反应的影响显著,增大水的比例可加快反应速率,但有副产物生成,提高乙醇的比例可提高产物的纯度。 在室温下,使用10%KH2PO4为催化剂,2.5 mL乙醇和0.5 mL水作为反应介质,反应6 h后,产物的产率达到88%(表1,Entry 15)。 使用1.7 mL乙醇和0.3 mL水作为反应介质,产率进一步提高,达到93%(表1,Entry 18)。
| 表1 苯甲醛、吲哚和麦氏酸的三组分反应条件筛选 Table 1 Screening of reaction conditions for the multicomponent addition of benzaldehyde, indole and Meldrum's acid |
最后,考察了催化剂的用量和反应原料的物料比对反应的影响(表1,Entries 20~22),发现增加催化剂用量,收率不变,降低催化剂用量为8%时,收率降低到86%;改变3种原料的物料比时发现苯甲醛的用量为0.55 mmol时,产率可达96%(表1,Entry 22),进一步增加苯甲醛的用量,产率变化不大。 综上所述,最佳的反应条件是:以1.7 mL的乙醇和0.3 mL水作为反应介质,10%KH2PO4为催化剂,醛、吲哚和麦氏酸的物质量之比为1.1:1:1,反应温度为20 ℃,反应时间为6 h。
在确定的最佳反应条件下,探讨催化剂KH2PO4的普适性,系统考察了不同的醛、吲哚与麦氏酸的三组分缩合反应。 由于电子效应和空间效应的影响使大部分芳香醛的反应活性降低,因此,延长反应时间到10 h。 从表2可看出,大多数芳香醛均能顺利地参与三组分反应,并以良好的收率得到相应的目标产物,但它们反应活性变化情况较复杂,同时受电子效应和空间效应的影响。 从电子效应来看,当苯甲醛对位和间位上连有强吸电子取代基团时反应活性升高,例如硝基,产物收率高达98%和96%(表2,Entry 12,Entry 13)。 由于卤素的吸电子能力低于硝基,所以其取代的苯甲醛参与的反应的收率明显低于硝基取代的苯甲醛。 从空间效应来看,邻位取代的苯甲醛的反应活性一般低于苯甲醛,特别是2-氯苯甲醛、2-溴苯甲醛、2-硝基苯甲醛虽然含有吸电子基团,使芳环和羰基上的电子云密度降低,但可能是由于空间位阻或形成分子内氢键等原因反应活性很低(表2,Entry 9),甚至难以发生反应。 值得注意的是含有给电子基团的2-甲基苯甲醛不发生缩合反应,但2-甲氧基苯甲醛的反应结果与未取代的苯甲醛相当(表2,Entry 6)。 另一方面,与芳香醛相比脂肪醛反应活性较差,反应速度慢,延长反应时间到48 h,产率依旧不高,而且在该反应体系中异丁醛的反应活性优于正丁醛(表2,Entry 15,Entry 16)。 当吲哚的1位被甲基取代后,其反应活性降低,与麦氏酸、苯甲醛或对硝基苯甲醛反应后产物的纯度和产率均有所降低(表2,Entry 18,Entry 19)。
| 表2 催化体系的底物扩展 Table 2 Scope of substrate for the synthesis of product 4 |
以常见的磷酸二氢钾为催化剂、水和乙醇混合液为溶剂组成的反应体系可以高效的促进醛、吲哚和麦氏酸的三组分缩合反应。 本文系统的考察了不同的醛的反应活性,合成了一系列5-[(3-吲哚基)-芳甲基]-2,2-二甲基-1,3-二噁烷-4,6-二酮化合物。 此方法最突出的优点是反应条件温和、催化剂廉价易得、部分产物不需要进一步提纯、后处理简单、产率较高,另外,还可以有效的促使富电子的4-甲基苯甲醛和4-甲氧基苯甲醛参与反应,扩展了 β-取代吲哚类化合物的合成途径。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|