利用混合静电纺丝将葡萄糖淀粉酶(GA)固定于聚丙烯酸(PAA)/聚乙烯醇(PVA)纳米纤维膜上,并通过鉴定固定化GA的酶学特征检验PAA/PVA可否成为一种优良的酶固定化载体。 对其理化性质和酶学特征进行鉴定,经红外光谱(FT-IR)和扫描电子显微镜(SEM)表征发现,GA可成功包埋于PAA/PVA纳米纤维膜内部;对包裹固定的GA进行酶学性质鉴定,发现固定化GA的最适反应温度为68 ℃,比游离GA提高了9 ℃;固定化GA的适用pH值范围明显变宽;热稳定性和存贮稳定性显著增强且可以重复使用。PAA/PVA纳米纤维膜是一种优良的酶固定化载体,可以通过混合静电纺丝包埋法简便地将蛋白质分子固定于其内部,具有一定的应用前景。
Glucoamylase(GA) was entrapped and immobilized in the poly(acrylic acid)(PAA)/polyvinyl alcohol(PVA) nanofibers membrane by the mixed liquid electrospinning entrapping method. The enzyme immobilization potential of PAA/PVA was investigated through appraised enzymatic characterization of immobilized GA. Its physicochemical properties and enzymatic characterizations were identified. Fourier transform infrared spectrum(FT-IR) and scanning electron microscope(SEM) photographs indicate that GA can be successfully entrapped in the interior of the electrospinning PAA/PVA composite nanofiber membrane. The optimum reaction temperature of immobilized GA is 68 ℃, 9 degrees higher than that of free GA, and the applicable pH range of immobilized GA is wider than that of free GA significantly. In addition, immobilized GA also has good thermal stability, storage stability and reusability. PAA/PVA nanofiber membrane is a good carrier for enzyme immobilization with potential application. The protein molecules can be easily fixed into the inside of nanofiber membrane via mixed liquid electrospinning entrapping method.
酶的固定化技术是现代酶学工程中的一种重要方法及手段,酶被固定于载体后既能保持其原有的高催化效率、专一性及温和的反应特性,又能表现出较高的稳定性、产物易于分离纯化的特点[1]。 固定化酶还可多次重复使用,在生产实践中具有利用率高、操作连续可控等多种优点,因此在生物、医药、食品、医学及生命科学等相关领域得以迅速发展[2]。 经过数十年的研究发展,固定化酶技术已经比较成熟,而性能优异的载体材料的研发已成为固定化酶技术最为活跃的研究方向之一。 固定化酶载体材料要求具有较大的比表面积,不溶于水,机械刚性和稳定性强,能防止微生物降解,最好还要无毒、无污染、成本低廉、来源丰富[3]。
在诸多纳米材料中,静电纺丝法制备的纳米纤维膜十分符合作为固定化酶载体材料的特点,是一种优良的酶固定化载体,而且制备成本低、工艺简单[4]。 纳米纤维膜包埋法是一种已经比较成熟的酶固定化方法,其原理是通过静电纺丝技术,在制备纳米纤维膜的过程中直接将酶纺入纳米纤维内部,从而实现酶的固定化,这种原位固定酶的方法具有操作简单、载酶量大、酶活力损失少等优点[5]。 本文采用静电纺丝法制备聚丙烯酸(poly acrylic acid,PAA)/聚乙烯醇(polyvinyl alcohol,PVA)/葡萄糖淀粉酶(glucoamylase,GA)复合纳米纤维膜,通过共价交联方法使纤维薄膜具备疏水性的特点,达到固定化和重复多次使用的目的,同时鉴定固定化GA的酶学特征,为进一步研究新型固定化酶载体材料提供依据。
H-7500型场发射环境扫描电子显微镜(SEM,日本HITACHI公司);Magna 560型傅里叶红外光谱仪(FT-IR,美国NICOLET公司),其扫描范围为4000~400 cm-1;UV-2550型紫外-可见分光光度计(日本SHIMADZU公司);高压静电纺丝装置(吉林大学化学学院自组装);振荡培养箱(上海精密仪器仪表公司)。 聚丙烯酸(PAA, Mw=450000)购于阿拉丁试剂公司;聚乙烯醇(PVA,聚合度175±50)购于安徽皖维高新材料股份有限公司;50%戊二醛购于美国Sigma公司;葡萄糖淀粉酶(GA)购于苏柯汉(潍坊)生物工程有限公司;可溶性淀粉、3,5-二硝基水杨酸、Na2SO3、结晶酚、氢氧化钠、酒石酸钾钠、乙酸、醋酸钠、磷酸二氢钠、磷酸氢二钠等分析纯试剂均购于北京化工厂。
将溶液浓度为100 g/L PVA、80 g/L PAA、2 g/L GA按照 V(PVA): V(PAA): V(GA)=1:1:5混合,在常温条件下搅拌均匀,避光静置12 h。 将混合溶液置于带有电极的塑料管中,调节合适的静电纺丝参数,工作电压控制在12~14 kV、喷口与接收板的距离为15~18 cm、喷口直径1 mm、溶液流速0.8~1.0 mL/h,进行高压静电纺丝。 将静电纺丝所获得的纤维薄膜置于戊二醛的蒸汽条件下,获得不溶于水的PAA/PVA/GA纳米复合纤维膜。
将一定质量的纤维膜浸泡于去离子水中,每隔一定时间取出,用滤纸吸干表面的水分后称重,考察复合薄膜在水中的稳定性和溶胀性能,如此反复多次,直至达到溶胀平衡。 不同时间的溶胀比( Qt)计算公式为:
Qt=( ms- m0)/ m0
式中, m0为纤维毡干燥时的质量, ms为纤维膜在去离子水中浸泡不同时间后的质量。
GA活力单位定义:在pH=4.6、温度为58 ℃时,1 h内GA水解淀粉释放出1 mg 还原糖所需要的酶量为一个酶活力单位(U)。 酶比活力定义:单位质量的游离酶或载酶纳米纤维膜所具有的酶活力单位数,计量单位为U/g。 反应液是由10 mL的2%淀粉溶液和5 mL的pH=4.6醋酸缓冲液混合而成。 在58 ℃ 水浴条件下加热10 min后,加入0.5 g载酶纳米纤维膜,在58 ℃恒温反应20 min。 反应结束后,立刻将反应液置于沸水浴中10 min,终止酶反应。以葡萄糖的含量(mg)为横坐标,550 nm处吸光度值(OD540)为纵坐标绘制标准曲线,生成的葡萄糖量采用3,5-二硝基水杨酸(DNS)法测定。
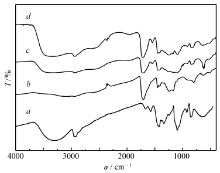
图1为PVA、PAA原料、PAA/PVA/GA交联前后的红外光谱图。 PVA原料的红外谱图上,3294 cm-1的宽峰归属于O—H的伸缩振动;2924、1663、1430、 1335、 650 cm-1为C—H、C—C、C—O、O—H的伸缩振动峰;1091 cm-1是C—O(多缔和体)单键伸缩和O—H弯曲振动吸收峰。 PAA的原料在1701 cm-1的吸收最大,该特征峰属于羧酸中—C=O的伸缩振动;在1451和1413 cm-1处的吸收振动峰分别归属于H—C—H弯曲振动和—COOH的变形振动;1250和1171 cm-1的两处振动峰为—C—O的特征谱带。 在PAA/PVA/GA纳米纤维膜中,1540 cm-1出现的特征峰归属于酰胺中的N—H变角振动和C—N弯曲振动,即酰胺化合物的吸收带Ⅱ;1266 cm-1处的峰为C—N伸缩振动和N—H键的弯曲振动所引起的,属于酰胺吸收带Ⅲ;通常认为这些特征峰主要来源于肽键骨架基团的振动[6]。 与原料相比,位于3500~2500 cm-1之间的吸收峰明显变宽而且发生了左移,说明存在糖化酶分子与聚合物分子间的氢键,糖化酶已经被成功地包裹于PAA和PVA聚合物中。 对于交联后的复合纤维薄膜来说,在2857 cm-1的吸收峰归属于醛基中C—H的伸缩振动;1710 cm-1处的振动峰与交联前相比峰强度增加,主要源于PVA分子中的羟基与戊二醛中的一个醛基发生半缩醛反应后,未参与反应的醛基基团的伸缩振动。 在1385 cm-1处新出现的振动峰归属于羟醛缩合反应所形成缩醛环及醚键的伸缩振动,这是在酸性条件下羟基和醛类化合物发生化学反应的结果[7]。
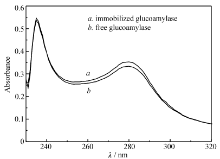
许多生理功能的实现与蛋白质的结构密切相关,结构的稳定及正确的折叠是蛋白质执行各种生物功能的基础。 蛋白表面氨基酸在蛋白质结构稳定性中发挥作用,氨基酸残基的微环境一般由蛋白质分子的构象决定,构象改变将使微环境改变,从而导致生色基团的紫外吸收光谱也随之发生改变。 若蛋白质吸收光谱发生强度改变或位移时,说明蛋白质的构象发生了变化[8],波长为235 nm处出现的吸收峰是由酶蛋白的肽链骨架中酰胺键(肽键)对光的吸收产生,该吸收峰与肽骨架构象有关,在280 nm处呈现的吸收峰是由酶蛋白分子中色氨酸和酪氨酸残基对光的吸收产生,该吸收峰与侧链基团的空间结构有关[9,10]。 本文采用紫外可见光谱法分别对游离酶和固定化酶的空间结构进行测定和比较,从而探讨采用包埋法制备PAA/PVA/GA复合材料中酶结构的稳定性。 从紫外光谱图中已看出,与游离酶相比,固定化酶在235和280 nm两处的吸收峰没有位移现象,在强度上也仅发生了微弱的变化,说明包埋后的GA基本保持了游离酶的结构,没有发生明显改变。
图3显示了PAA/PVA/GA复合纤维在交联前后的扫描电子显微镜照片。 从图3可以看出,在没有糖化酶存在下,经过高压静电纺丝获得了分布均匀且表面光滑的PAA/PVA复合纤维;但二者高聚物与GA混合后形成三元复合纤维,其直径减小但整体分布不均匀且有纺锤体出现。 原因在于糖化酶是一种蛋白质分子,它由许多氨基酸残基组成, 在分子内及分子间存在很强的氢键作用,使分子不能呈现规则的排列, 所以GA的加入削弱了溶液形成纺丝喷射细流的能力,从而产生了梭状的突起[11]。 经过交联后纤维直径变大,局部有粘连现象,说明在复合纤维中PVA或者少量的糖化酶与戊二醛会发生交联反应;但经过浸泡36 h后,仍然保持了原来的纤维形貌,说明三元复合纤维经过交联后保持了良好的水的稳定性。
PAA、PVA、GA三者均属于水溶性物质,然而作为固定化载体材料来说,纺制的纳米纤维膜必须具有疏水性质,保证其优异的使用性能。 在本实验中不易采用热交联方法,主要原因在于GA在较高温度下容易使糖化酶的活性丧失,因此,本实验采用化学共价法进行交联,其原理如Scheme 1所示。 在PAA作为酸性催化剂,戊二醛蒸气与PVA进行化学交联,生成了疏水性的化合物。 应用戊二醛蒸气交联方法,在保证了材料的疏水性的同时又阻止了糖化酶的失活[12,13]。
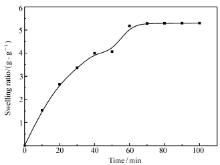 | 图4 交联后的PAA/PVA/GA纳米纤维膜在不同时间的溶胀比Fig.4 Swelling ratios of cross linked PAA/PVA/GA nanofiber membrane as a function of time |
图4是交联后PAA/PVA/GA纳米纤维膜在去离子水中时的溶胀性测试,实验结果表明,经过交联纳米纤维膜在最初的60 min内,浸泡在去离子水中的纤维膜质量随着时间的延长而逐渐增加,70 min后PAA/PVA/GA纳米纤维膜的质量基本达到平衡,通过公式计算得出最高溶胀比为5.29 g/g;然而当把交联前的PAA/PVA/GA纳米纤维膜浸泡在水中后,薄膜瞬间就会全部溶解。 分析交联前后纤维薄膜的溶胀性,可以认为未经过交联处理的PAA/PVA/GA纳米纤维膜能够迅速溶解于水的原因在于:巨大的比表面积和立体网状结构能够产生较大的孔隙率,使得水分子能够快速地进入纤维薄膜的各个部分,从而导致纤维薄膜迅速溶解于水。 经过交联处理后的PAA/PVA/GA纳米纤维膜,孔隙率不仅明显降低,而且在酸的作用下,PVA与戊二醛作用生成了不溶于水的六元环缩醛结构,使得交联后的PAA/PVA/GA复合纤维的疏水性有显著的提高。
2.5.1 酶活力 以吸光度值为纵坐标,葡萄糖浓度(g/L)为横坐标,测定并计算出回归方程为 y=1 .8392 x+0.0126( R2=0.9997)。 经测定PAA/PVA/GA纳米纤维膜的GA的固化率(26.53±1.72) mg/g,与化学结合法制备的PVA/GA纳米纤维膜比较[14],PAA/PVA/GA纳米纤维膜中酶的固化率显著提高。 固定化酶的比活力却并没有随之明显提高,其比活力为(892.74±17.25) U/g,而实测游离酶活性为(8645.91±73.29) U/g,其活性实际下降了89.67%,其原因可能是包埋法制备的固定化酶被部分包裹在纤维内部,而导致酶活力偏低。
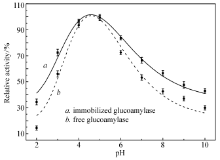
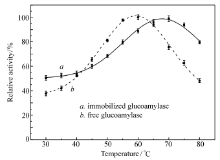
2.5.2 最适反应pH值和最适反应温度 通过在不同pH值和温度条件下测定固定化的GA与游离的GA的酶比活力,结果发现,游离酶与固定化酶的最适pH值基本相同,分别为4.61和4.57(图5);固定化前后GA的最适催化反应温度发生较大改变,游离酶的的最适反应温度为59.2 ℃,与产品说明一致,而固定化酶的最适反应温度为68.1 ℃,比游离酶提高了约9 ℃(图6)。 固定化酶的适用温度范围和pH值适用范围均较游离酶明显变宽,这可能是由于PAA/PVA纳米纤维膜的包裹使得酶免受外界环境的影响。
2.5.3 酶促反应动力学参数 根据底物浓度及酶促反应速度作Lineweaver-Burk双倒数曲线图,结果见图7。 通过回归方程求得固定化GA的 Km值为14.97 g/L, vmax为4.29 g/(L·h);游离GA的 Km值为8.39 g/L, vmax为11.04 g/(L·h)。
由酶促反应动力学参数比较发现,固定化GA的 Km值大于游离GA的 Km值,即固定化酶对底物的亲和力要小于游离酶,同时固定化酶的最大酶促反应速度 vmax小于游离酶的 vmax。 这可能是由于酶的固定化使酶分子的空间自由度受到了载体的空间障碍和扩散限制作用,使得酶与底物分子接触受阻,最终导致酶对底物的亲和性降低。 另一方面原因,也可能是固定于载体的酶分子活性中心的空间构象发生改变,影响了酶活性中心对底物分子的定位作用。
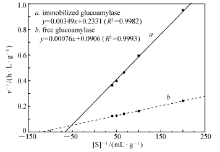 | 图7 葡萄糖淀粉酶Lineweaver-Burk双倒数曲线Fig.7 Double-reciprocal plot of glucoamylase from Lineweaver-Burk equation |
2.5.4 热稳定性和贮存稳定性 将固定化GA和游离GA置于pH=4.6的醋酸缓冲液中,在不同温度条件下保持1 h后测定酶活力,以此鉴定其热稳定性,结果如图8所示。
固定化酶的热稳定性要明显优于游离酶,因为GA被PAA/PVA纳米纤维膜固定后,其最适温度提高至70 ℃附近,而游离GA的最适温度约为60 ℃,但在环境温度高于80 ℃以上时,两种酶的活力均明显下降。 此外,在4 ℃条件下,将游离酶溶液和湿态的PAA/PVA/GA复合纳米纤维膜贮存于密封的容器中,每隔2 d取出一定量分别测定酶的活力,观察酶活力的降低趋势,鉴定其贮存稳定性。 结果如图9所示,固定化GA和游离GA的活力均随着储存时间的延长而降低,但经PAA/PVA纳米纤维膜固定化的GA贮存稳定性显著提高。 储存20 d后,游离酶只能保留初始酶活力的21.59%,而固定化酶仍能保持初始酶活力的79.52%。 固定化GA的热稳定性和贮存稳定性均优于游离酶,其原因可能是PAA/PVA纳米纤维膜对包埋在其内部的酶分子具有较强的保护作用,屏蔽了外界环境对酶蛋白的影响。
2.5.5 重复使用性 重复使用性是衡量固定化酶在工业上是否具有广泛应用性的重要指标。取反应后的固定化GA用蒸馏水冲洗3次,以去除表面的底物和产物溶液,然后再在pH值4.6,68 ℃下重复使用,连续重复使用10次并测定其酶活力。 结果发现,在第6次使用后酶活力开始显著降低,此后酶活力逐渐呈梯度式下降(图10)。 经多次重复使用后,固定化GA酶活力下降的原因可能在于包埋的酶蛋白是水溶性的,载酶纳米纤维膜在水溶液中长时间浸泡,会发生纤维膜膨胀或者解体现象,而导致酶的泄漏,降低固定化酶的重复利用性。
利用高压静电纺丝技术和交联方法可成功制备疏水性PAA/PVA/GA复合纳米纤维膜,经扫描电子显微镜和红外光谱进行表征,确定复合纤维的形貌及负载GA分子后的内部结构特征,同时对其酶学特征进行鉴定。 结果表明,固定化GA一定程度的保持了原酶(游离酶)的活性,同时拓宽了GA的最适反应温度、最适pH值,增强了GA的热稳定性和储存稳定性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|