以芦丁(RT)-槲皮素(QT)为混合模板分子制备了芦丁-槲皮素复合模板分子印迹聚合物。 优化了制备条件,研究了模板用量比、功能单体及交联剂用量对印迹聚合物吸附性能的影响。 用傅里叶红外光谱和扫描电镜对分子印迹聚合物进行结构表征。 探讨了分子印迹聚合物的吸附动力学、等温吸附及键合位点特征,考察了其选择识别性能,并以分子印迹聚合物为吸附介质,萃取分离芦丁粗提液中的目标化合物。 结果表明,当槲皮素与芦丁的摩尔比为3:2,且模板总量与功能单体及交联剂用量摩尔比为1:8:10时,所得分子印迹聚合物的吸附性能最好,对槲皮素和芦丁的吸附量分别达47.86和60.97 mg/g。 吸附可在3.5 h内达到平衡,显示了较快的吸附动力学。 Scatchard分析表明,分子印迹聚合物基体中存在四类不同性能的键合位点,分别为芦丁和槲皮素的高亲和键合位点及非选择键合位点。 相对分布系数( k=Kd(RT)/ Kd(QT), Kd= qe/ ρe, Kd为分布系数, qe为平衡吸附量, ρe为平衡质量浓度)大于1,表明了分子印迹聚合物对芦丁具有更高的选择键合作用,当模拟混合物中芦丁和槲皮素浓度分别为0.07和0.03 mmol/L时,相对分布系数和分离因子( α=qe(RT)/ qe(QT))分别达6.669和25.02。 另外,以乙腈、甲醇及甲醇-醋酸混合物依次为洗脱剂,通过分子印迹固相萃取可从槐米提取物中分离芦丁和槲皮素两种黄酮类化合物,总回收率分别为96.70%和94.67%。
A bi-templates molecular imprinted polymers(MIPs) was prepared by using quercetin(QT) and rutin(RT) as co-templates. The preparation conditions were optimized. The effects of the molar ratio of two templates and the volume dosage of functional monomer and crosslinker on the adsorption property of MIPs were also studied. Structural characterization of the MIPs was performed by FTIR and SEM. The adsorption dynamics, adsorption isotherm, surface sites distribution and binding selectivity of the MIPs were explored. In addition, the applicability for the MIPs to separate target compound by MIPs solid phase extraction was studied. When the molar ratio of quercetin to rutin is 3:2 and the molar ratio of total templates to functional monomer to cross-linker is 1:8:10, the MIPs obtained possess the highest adsorption capacity toward two templates(47.86 mg/g for quercetin and 60.97 mg/g for rutin). The equilibrium of static adsorption is reached within 3.5 h implying a rapid adsorption dynamics. Scatchard analysis shows that there are four types of binding sites in the polymer matrix, i.e., two types of high affinity binding sites toward two templates and two types of non-selective recognition sites. The relative distribution coefficient( k=Kd(RT)/ Kd(QT), Kd= qe/ ρe, Kd—distribution coefficient, qe—equilibrium adsorption amount, ρe—equilibrium mass concentration) much higher than 1.0 reveals a high selectivity for the MIPs toward rutin. The highest relative distribution coefficient(6.669) and separation factor( α=qe (RT)/ qe(QT))(25.02) are obtained when the concentration of rutin and quercetin in the model mixture is 0.07 and 0.03 mmol/L, respectively. When using acetonitrile, methanol and methanol-acetic acid mixture as effluents in sequence in the MIPs solid phase extraction of crude extract of sophora flower bud, quercetin and rution can be separately extracted with 96.70% and 94.67% recoveries, respectively.
分子印迹技术是一种在高度交联及刚性的聚合物母体中引入特定分子结合位点的新技术[1]。 利用这种人工技术制备的分子印迹聚合物(molecularly imprinted polymers,MIPs)对模板分子具有“记忆”功能,可用于对模板及其结构类似物的高选择键合,同时这种印迹材料物理化学性质稳定。 迄今分子印迹聚合物已广泛用于固相萃取[2]、色谱分离[3]、吸附[4]、催化合成[5]、催化降解[6]、药物传输与释放[7]及化学仿生传感器[8]等领域。 基于印迹材料对目标分子的特定选择性,目前人们大多致力于研究单一模板分子的印迹体系。 然而,由于分子印迹的交叉选择识别[9,10],拓宽了其识别范围,可用于对模板分子及其结构相似物的同时识别。 以两种或两种以上结构类似物为模板制备分子印迹聚合物,正是利用这种交叉识别能力,有可能实现对复杂体系中同类化合物或药物某一活性部位的同时提取,因而极具研究和应用价值。
槲皮素(QT)和芦丁(RT)属黄酮类化合物,具有降血压、降血脂、抗癌、增强毛细血管抵抗力等药用价值[11],广泛分布于银杏、金银花、三七、杜仲等植物中,是中草药中重要的活性成分。 单纯以槲皮素或芦丁为模板制备分子印迹聚合物并进行识别研究已见诸报道[12,13,14]。 本工作拟以槲皮素和芦丁作为混合模板分子制备复合模板印迹聚合物,考察分子印迹聚合物对槲皮素及芦丁分子的吸附和选择识别性能,并研究了复合模板印迹聚合物的固相萃取应用性能,以期实现对实际样品中槲皮素和芦丁的同时分离分析。
槲皮素(97%)和芦丁(98%)标准物质购自西安Sciphar生物技术有限公司,其分子结构如图1所示。 4-乙烯基吡啶(4-VP)、乙二醇二甲基丙烯酸酯(EGDMA)购自阿拉丁化学有限公司,偶氮二异丁腈(AIBN)、乙腈、甲醇、乙酸购自科密欧化学试剂公司,这些试剂均为分析纯。 水为二次蒸馏水,使用前用0.45 μm微孔膜过滤。
LC2010-AHT型高效液相色谱(日本岛津公司);S-3400型扫描电子显微镜(日本岛津公司);IR-Affinity-1型傅里叶变换红外光谱仪(日本岛津公司);电子天平(上海民桥精密科技有限公司);SHB-Ⅲ型循环水式多用真空汞(郑州长城科工贸有限公司);电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂);DF-101S型集热式加热磁力搅拌器(巩义市予华仪器有限公司);KQ-250E型超声振荡器(昆山市超声仪器有限公司)。
芦丁-槲皮素样品溶液的制备:对文献[15]方法改进后进行提取。 称取2.00 g干燥的槐米叶,放入50 mL烧瓶中,加水20.00 mL,磁力搅拌加热煮沸10 min,过滤,收集滤液,固体再用20.00 mL水重复提取2次,合并提取液。 滤液于10 ℃冷藏20 h,过滤,将固体重新溶于5.00 mL甲醇溶液中,制得芦丁-槲皮素样品溶液,备用。 液相色谱分析表明,该溶液中含芦丁32.60 g/L,槲皮素3.15 g/L。
如表1所示,按比例称取模板分子溶于3.00 mL乙腈中,震荡10 min,加入不同量的功能单体4-VP,震荡30 min,再加入交联剂EGDMA和10.00 mg 引发剂AIBN,充分混合后,转入圆底烧瓶,超声脱气15 min,通入Ar气15 min,封闭瓶口。 将圆底烧瓶放入60 ℃恒温水浴锅中反应24 h。 将所得的块状聚合物磨碎,过75 μm筛孔,所得聚合物放入索氏提取器中,依次甲醇-乙酸混合溶液(体积比,9:1)、甲醇回流提取24 h,固体放入真空干燥箱于60 ℃中干燥10 h,即得分子印迹聚合物,置于干燥器中备用。
| 表1 双模板分子印迹聚合物的制备 Table 1 Preparation of Bi-templates imprinted polymers |
非印迹聚合物(NIP)的制备按相同的方法进行,但不加模板分子。
1.3.1 吸附动力学实验 准确称取分子印迹聚合物(MIP)10.00 mg于磨口锥形瓶中,加入10.00 mL槲皮素或卢丁乙腈标准溶液(0.10 g/L),每间隔0.5 h,取样0.20 mL并过0.45 μm微孔滤膜,收集滤液,用高效液相色谱法分析测定滤液中槲皮素或卢丁浓度,计算不同时间下分子印迹聚合物对槲皮素或卢丁的吸附量。
1.3.2 等温吸附 准确称取分子印迹聚合物(MIP)5.00 mg于磨口锥形瓶中,加入5.00 mL不同浓度的槲皮素或卢丁乙腈溶液(质量浓度为0.050~0.500 g/L),室温下静态吸附4 h后,用0.45 μm微孔膜过滤,收集滤液,用高效液相色谱法测定滤液中槲皮素或卢丁浓度,按下式计算槲皮素或卢丁的平衡吸附量 qe(mg/g)。
qe=( ρ0- ρe)
式中, ρ0为槲皮素或芦丁的初始质量浓度(mg/L), ρe为平衡质量浓度(g/L), V为溶液体积(mL), m为吸附剂的质量(g)。
1.3.3 竞争吸附及吸附选择性 准确称取印迹聚合物(MIP)5.00 mg多份于锥形瓶中,分别加入5.00 mL不同配比的槲皮素-芦丁混合溶液(物质的量比3:7、1:1、7:3,QT/RT),于室温下吸附4 h后,用0.45 μm微孔滤膜过滤,收集滤液。 高效液相色谱测定滤液中槲皮素和芦丁浓度,计算槲皮素和芦丁的竞争吸附量,并按下式计算分子印迹聚合物的分布系数 Kd、相对分布系数 k及分离因子 α。
Kd= qe/ ρe
k=Kd(RT)/ Kd(QT)
α=qe (RT)/ qe(QT)
式中, Kd(QT)、 Kd(RT)分别为槲皮素和芦丁在分子印迹聚合物上的分布系数; qe(QT)、 qe(RT)分别为槲皮素和芦丁在分子印迹聚合物上的平衡吸附量。
1.4.1 装载 分别称取1.00 g分子印迹聚合物和非印迹聚合物填入两支固相萃取筒中。 取两份芦丁-槲皮素混合样品溶液(每份1.00 mL),分别流经装有MIPs和NIPs聚合物的固相萃取器,收集流出液。 用高效液相色谱测定流出液中芦丁和槲皮素的质量。
1.4.2 冲洗和洗脱 吸附有芦丁和槲皮素的分子印迹聚合物先用3.00 mL乙腈冲洗,再用3.00 mL甲醇、3.00 mL甲醇-醋酸(体积比,9:1)混合溶液洗脱,收集各部分冲洗液和洗脱液,用高效液色谱测定收集液中两种化合物的浓度。
高效液相色谱分析在C18柱(4.6 mm×150 mm,5 μm,依利特分析仪器有限公司)上进行,流动相为甲醇-水-乙酸(55:42:3, 体积比)混合物,流速为1.00 mL/min,检测波长为360 nm,进样量为10.0 μL,柱温为30 ℃。 用标准曲线法进行定性和定量。
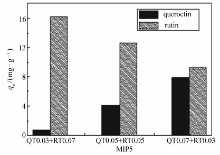
改变聚合体系中两种模板的物质的量比分别为1:1、3:2、2:3,同时改变功能单体和交联剂的用量,制备了6个双模板分子印迹聚合物(MIP1-6)、2个单模板印迹聚合物(MIP7,MIP8)和3个非印迹聚合物,如表1所示。 分别测试了8种分子印迹聚合物及3种非印迹聚合物对槲皮素和卢丁的静态吸附量,图1显示了各种聚合物吸附量的平均值及标准偏差。 可以发现,MIP5对两种模板分子均具有最好的吸附性能,对槲皮素和卢丁的吸附量分别为47.86和60.97 mg/g。 尽管槲皮素的用量高于芦丁,但印迹聚合物对芦丁的吸附量仍高于槲皮素,这可能是由于:芦丁分子结构中,除了具有槲皮素分子的基本功能基团外,还有糖基,以芦丁为模板而形成的印迹空穴会对芦丁显示高选择结合作用;由于芦丁分子包含有槲皮素的分子结构,以槲皮素为模板形成的印迹空穴可能对芦丁分子产生部分结合。 基于MIP5对模板分子的高吸附性能,因此选用其进行后面的吸附与应用研究。
 | 图1 槲皮素( A)及芦丁( B)在聚合物上的吸附量及标准偏差 ( n=3)Fig.1 Adsorption capacity of quercetin( A) and rutin( B) on polymers and its standard deviation( n=3) |
2.1.1 功能单体用量对MIPs吸附性能的影响 保持其它条件不变,功能单体用量从0.40 mmol增加到0.80 mmol,制备了分子印迹聚合物MIP1和MIP3,通过比较两种分子印迹聚合物对两种模板分子的吸附量(见图1),可以发现,功能单体用量较高时,制备的分子印迹聚合物吸附量大。 这可能是由于功能单体用量大时,增加了聚合物基体中识别位点的数目。
2.1.2 交联剂用量对MIPs吸附性能的影响 保持其它条件不变,交联剂用量从1.00 mmol增加到1.50 mmol,制备了分子印迹聚合物MIP1和MIP2,通过比较两种分子印迹聚合物对两种模板分子的吸附量(见图1),可以发现交联剂用量增加,分子印迹聚合物对两种模板的吸附量没有明显改变。
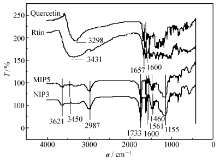 | 图2 槲皮素、芦丁、分子印迹聚合物(MIP5)和及非印迹聚合物(NIP3)的红外光谱图Fig.2 FT-IR spectrum of quercetin, rutin, molecularly imprinted polymer(MIP5) and non-imprinted polymer(NIP3) |
2.1.3 模板比例对MIPs吸附性能的影响 固定模板分子总量、功能单体和交联剂用量分别为0.10,0.80和1.00 mmol, 改变两种模板分子的量比分别为1:1、3:2和2:3,制得分子印迹聚合物MIP3、MIP5和MIP6(参见表1)。 通过比较3种分子印迹聚合物对两种模板的吸附量(图1),发现MIP5对两种模板的吸附量均最高。 这可能是由于模板分子的结构对印迹位点的形成和识别产生影响的原故。
2.1.4 混合模板印迹聚合物与单模板印迹聚合物的吸附性能对比 固定模板分子总量、功能单体和交联剂用量分别为0.10、0.80和1.00 mmol,制备了分子印迹聚合物MIP5、MIP7和MIP8(表1)。 通过比较混合模板印迹聚合物和单模板印迹聚合物对两种模板的吸附量(图1),可以发现混合模板印迹聚合物的吸附量均高于单模板印迹聚合物。
另外,非印迹聚合物对两种模板化合物也具有一定的吸附量,这可能是由于交联剂分子中含有与模板分子相似的功能基团的原故。
2.2.1 分子印迹聚合物的红外光谱分析 测试了两种模板分子、分子印迹聚合物(MIP5)和非印迹聚合物(NIP3)的红外吸收光谱,如图2所示。 两种模板分子呈现几个特征吸收峰,3298和1600 cm-1处的吸收分别为槲皮素分子中的—OH基和C=O基伸缩振动吸收峰,而芦丁分子中—OH基和C=O基的伸缩振动吸收分别在3431和1657 cm-1处出现。 MIP5和NIP3的红外光谱图中,3621 cm-1处的吸收为—N—H伸缩振动吸收峰,3450 cm-1为—OH基伸缩振动吸收,2987 cm-1处的吸收为亚甲基中的C—H键伸缩振动吸收峰,1733 cm-1处强吸收峰为羰基C=O伸缩振动吸收。 1600、1561和1460 cm-1处的吸收分别为吡啶环伸缩振动吸收、C=C双键和C=N双键伸缩振动吸收,1155 cm-1处的吸收为C—H键面内弯曲振动吸收峰。 另外,MIP5与NIP3的红外光谱未见明显差别,这可能是由于两种聚合物中所含化合物具有相似功能基团的缘故,以及残留溶剂的影响。
2.2.2 分子印迹聚合物的电子显微镜分析 用扫描电子显微镜(SEM)测试了MIP5和NIP3的颗粒大小、孔结构和形貌特征,如图3所示。 可以观察到MIP5的表面粗糙,结构疏松并有很多孔穴,这些微孔结构有利于分子印迹聚合物的吸附作用,而NIP3表面较为光滑,结构致密。
测试了分子印迹聚合物(MIP5)对两种模板分子的吸附量随时间的变化关系,如图4所示。 由图4可知,MIP5对槲皮素和芦丁的吸附量随着时间增加而增加,约3.5 h达到饱和吸附。 表明混合模板印迹聚合物对两种模板均具有较快的吸附动力学。 而非印迹聚合物对两种模板分子的吸附量则随时间延长而缓慢增加。
图5 A和5 B分别给出了分子印迹聚合物MIP5对槲皮素和芦丁的吸附等温线,为了比较,图中也显示了非印迹聚合物NIP3对两种化合物的吸附等温线。 由图可知,MIP5对两种模板的吸附量随其底物初始浓度增加而增大,当底物浓度相同时,分子印迹聚合物的吸附量高于非印迹聚合物对同种模板分子的吸附量。 这是由于分子印迹聚合物基体中含有大量与模板分子在大小、性状及功能基方面相匹配的键合位点。 此外,通过比较图5 A与图5 B,也可发现当两种模板分子初始浓度相同时,分子印迹聚合物对卢丁的吸附量高于对槲皮素的吸附量,这显示了分子大小和性状对印迹位点识别性能的影响。 这里,采用Scatchard模型评价了分子印迹聚合物对两种模板分子的吸附参数。 通常,Scatchard[16,17]方程可表达为:
式中, qe(mg/g) 为平衡吸附量, ρe(mg/L)为平衡质量浓度; Qmax(mg/g)为 MIPs中结合位点的最大表观结合常数, K(mg/L)为结合位点的平衡离解常数。
 | 图5 分子印迹聚合物(MIP5)分别对槲皮素( A)和芦丁( B)的吸附等温线及其Scatchard分析(插图)Fig.5 Adsorption isotherm( A, B) and its scatchard analysis(inset) for the MIP5 toward quercetin( A) and rutin( B) |
根据Scatchard公式,分别对两种模板化合物以 qe/ ρe对 qe作图,如图5 A和图5 B的插图所示。 可以发现,槲皮素和芦丁的Scatchard曲线均分成了两部分,两部分皆具有较好的线性关系,表明在分子印迹聚合物基体中,对于两种模板而言,均主要形成了两类不同性能的结合位点。 其中一类可能源于模板分子的印迹作用,另一类可能来源于功能单体或其它共存物的非印迹作用。 为了研究两类吸附位点的结合效能,通过线性拟合分别计算出了槲皮素及芦丁的平衡离解常数 K和饱和吸附量 Qmax的值,如表2所示。 最大表观键合常数越大,越有利于分子印迹的选择吸附。
| 表2 分子印迹聚合物(MIP5)吸附等温线的Scatchard分析及键合位点分布 Table 2 Scatchard analysis of adsorption isotherm for the MIP5 and binding sites distribution |
研究了分子印迹聚合物对两种模板分子的相对选择性,考察了在3种槲皮素-卢丁模拟混合物(摩尔比分别为0.03:0.07,0.05:0.05,0.07:0.03)溶液中,分子印迹的竞争吸附。测试结果如图6所示。 从图6可以看出,随模板混合物中槲皮素浓度升高,分子印迹聚合物对槲皮素的竞争吸附量增加,同样,当混合液中芦丁浓度升高时,其在印迹聚合物上的吸附量也增加。 为了比较分子印迹聚合物的选择识别作用,表3列出了竞争吸附条件下,分子印迹聚合物对两种模板分子的分布系数、相对分布系数及分离因子。 在3种比例的混合物模拟体系中,两种模板的相对分布系数( k=Kd(RT)/ Kd(QT))均大于1.0,表明分子印迹聚合物对芦丁具有较高的选择键合作用,特别当模拟混合物中芦丁浓度较高时,相对分布系数和分离因子( α=qe(RT)/ qe(QT))分别高达6.669和25.02。
| 表3 分子印迹聚合物MIP5对两种模板分子的分布系数、相对分布系数及分离因子 Table 3 Distribution coefficients, relative distribution coefficients and separation factors for the MIP5 toward two templates in competitive adsorption test |
考察了应用分子印迹固相萃取芦丁样品溶液中的目标化合物。 装载和洗脱结果示于表4中,从表4可见,对于分子印迹聚合物的固相萃取,在乙腈冲洗阶段,吸附的芦丁和槲皮素仅有极少量被洗脱,在甲醇洗脱阶段,大部分芦丁和少部分槲皮素被洗脱,两种化合物的回收率分别为80.29%和20.49%,在甲醇-醋酸(体积比9:1)混合液洗脱阶段,有11.60%的芦丁和72.59%的槲皮素被洗脱,通过MIPs固相萃取,芦丁和槲皮素得到了有效分离和富集,同时,分子印迹聚合物对芦丁和槲皮素的总回收率分别达96.70%和94.67%,这些结果表明以分子印迹聚合物固相萃取可以从槐米提取物中较好的分离芦丁和槲皮素两种黄酮类化合物;而对于非印迹聚合物,尽管也具有较高的回收率,但难以实现芦丁和槲皮素的有效分离和富集。
| 表4 装载和洗脱 Table 4 Loading and elution for MIPs solid phase extraction |
本文研究了芦丁-槲皮素复合模板分子印迹聚合物的制备及分子识别和应用性能。 用红外光谱法和扫描电子显微镜分析了聚合物的结构特征。 以吸附量为指标,优化了分子印迹聚合物的制备条件,当混合模板中槲皮素与芦丁的摩尔比为3:2, 模板总量、功能单体与交联剂用量比为1:8:10时,所得分子印迹聚合物对两种模板化合物均有最高的吸附量,分别为47.86和60.97 mg/g。 吸附动力学测试显示在3.5 h内可达到吸附平衡。 Scatchard分析表明在分子印迹聚合物基体中存在4类不同性能的键合位点,分别为芦丁和槲皮素的高亲和键合位点和对两种化合物的非选择性键合位点。 在不同模板比例的混合物模拟体系中,分子印迹聚合物对两种模板的相对分布系数( k=Kd(RT)/ Kd(QT))均大于1.0,特别是当模拟混合物中芦丁浓度较高时,相对分布系数和分离因子( α=qe(RT)/ qe(QT))分别达6.669和25.02,表明分子印迹聚合物对芦丁的较高选择键合作用。 以分子印迹聚合物为吸附介质,以乙腈、甲醇及甲醇-醋酸混合物依次为洗脱剂,通过固相萃取可从槐米提取物中较好的分离芦丁和槲皮素两种黄酮类化合物,总回收率分别为96.70%和94.67%。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|