共同通讯联系人:解正峰,教授; Tel:; Fax:; E-mail:xiezhf72@aliyun.com; 研究方向:有机合成
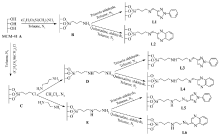
2-苯基-1,2,3-三唑醛和喹喔啉醛通过亚胺键固载到介孔分子筛MCM-41上,得到6种MCM-41固载多氮杂环席夫碱(L1~L6),用FT-IR、XRD和SEM等技术手段对所制得的固载席夫碱进行表征。 研究了以MCM-41固载多氮杂环席夫碱和金属盐偏钒酸钠为共同催化剂,过氧化氢为氧源,直接催化氧化苯合成苯酚,用气相色谱快速检测苯酚产率。 系统地考察了配体、金属盐、温度、溶剂、催化剂用量、反应时间、氧化剂等因素对反应的影响,产率最佳可达23.9%,选择性大于90%。 对催化剂扩大5倍量进行试验,得到23%的产率和93%的选择性,并且催化剂重复使用3次仍能达到19%的产率和90%以上的选择性。
Co-corresponding author:XIE Zhengfeng, professor; Tel:; Fax:; E-mail:xiezhf72@gmail.com; Research interests:organic synthesis
2-Phenyl-1,2,3-triazoledehyde and quinoxalin-2-carboxaldehyde immobilized on mesoporous MCM-41 by imine bond respectively. Six multinitrogen heterocyclic Schiff bases(L1~L6) modified MCM-41 were synthesized. These catalysts were characterized by Fourier transform infrared spectroscopy(FT-IR), X-ray diffraction(XRD), thermogravimetric analysis(TG) and scanning electron microscopy(SEM). NaVO3 and Schiff Base complex immobilized on MCM-41 was used for catalytic oxidation of benzene to phenol. The yield of phenol was determined by gas chromatography. Reaction conditions, such as ligand, metal salt, temperature, solvent, the catalyst amount, reaction time and oxidants were systematically investigated. Under optimized conditions, the yield of phenol is up to 23.9%(more than 90% selectivity). Scaled-up(5 times) reaction test using the current catalyst system gives a good yield(23%) and selectivity(up to 90%), while catalyst shows no significant decrease of catalytic activity after 3 times recycles.
苯酚是一种在石油化工、材料、农药、医药等方面有着广泛用途的化学中间体[1,2,3]。 传统的异丙苯法合成苯酚存在诸多缺点,如低产率、高能耗、高污染、产生副产物—丙酮[4,5,6];而苯一步催化氧化制备苯酚,是直接活化C—H键将羟基引入苯环而使其功能化的反应,特点是原子经济性高、过程简单、对环境污染小[7,8,9],其中以双氧水为绿色氧化剂,是合成化学中值得研究且有难度的课题,也成为近年来关注的热点。 相关报道中一步催化苯羟基化的催化剂主要有:杂多酸[10]、活性炭[11]、ZSM-5分子筛[12,13]、Fe/碳纳米管[14]等。 其中以分子筛为催化剂的研究多以高选择性为研究重点,高的选择性几乎为100%,但产率却不超过20%[15],所以苯酚的产率还有很大的提升空间,因而此类反应催化剂的研究仍一直是有机合成和工业催化研究领域的热点问题。
自1992年Mobil石油公司的科学家合成了新型有序的M41S系列介孔分子筛以来,分子筛的合成、修饰和改性就一直是研究的热点问题[16]。 介孔分子筛MCM-41被广泛应用于无机合成、功能材料、吸附、分离、光学、多相催化等方面。 近几年,本课题组将多氮杂环席夫碱配合物应用于催化有机反应[17,18],并将多氮杂环席夫碱固载到介孔分子筛MCM-41上用于催化有机反应[19,20,21,22,23],以期催化剂能够循环使用。 在此基础上,课题组以过氧化氢为氧源、多氮杂环席夫碱修饰的介孔分子筛MCM-41和偏钒酸钠共同为催化剂,一步催化氧化苯制备苯酚。 优化反应后得到苯酚的产率最佳可达23.9%,选择性不小于92.5%。
BRUKER EQUINX55型红外光谱仪(德国BRUKER公司),KBr。 ZF-2型三用紫外分析仪(上海市安亭电子仪器厂),用于薄层色谱的检测。 BrukerD8型X射线粉末衍射仪(德国BRUKER公司),采用Cu靶 Kα射线(0.54184 nm),管电压40 kV,管电流50 mA,扫描范围是5°~80°(2 θ)。 JW-BK型静态氮吸附仪(北京精微高博科学技术有限公司)。 Netzsch STA 449C型热分析-质谱联用仪(德国耐驰公司),25~800 ℃。 GC-14B型气相色谱仪(日本SHIMADAU公司),FID氢火焰离子化检测器;色谱柱30 m×0.25 mm i.d×0.25 μm,RTX- 5ms(J.&W.Scientific,California,USA)。 Agilent 6890/5973型气相色谱质谱联用仪(美国Kromat Corporation公司)。 所用试剂除特别说明外均为市售分析纯。
MCM-41介孔分子筛的合成及改性参见文献[24],2-苯基-1,2,3-三唑基-4-甲醛按文献[25]制备,喹喔啉-2-甲醛按文献[26]制备。
取1 g MCM-41分子筛(A)与6 mL氨丙基三乙氧基硅烷在甲苯中N2气保护下反应得到改性分子筛MCM-41(B) 1.2 g,干燥后取1 g改性分子筛B加入到100 mL三颈瓶中,然后加入5 mmol 2-苯基-1,2,3-三唑基-4-甲醛或喹喔啉-2-甲醛,在N2气环境下加入40 mL甲苯,滴加0.4 mL Et3N,70 ℃回流搅拌反应24 h。 溶液冷却至室温,过滤,将过滤后的产物用乙醚和二氯甲烷分别洗涤3次,产品烘干分别得灰白色粉末状固体1.1和1.1 g,分别记做配体L1和L2(Scheme 1)。
同改性分子筛B的制备方法,得改性的MCM-41(C),取1 g置于100 mL三颈瓶中,分别加入0.6 mL 1,3-丙二胺和乙二胺,在N2气保护下加入40 mL CH2Cl2,滴加0.4 mL Et3N,50 ℃回流搅拌反应24 h。 冷却至室温,过滤,溶剂洗3遍,35 ℃真空干燥,分别标记为改性分子筛D、E。 将改性分子筛D和E各置于4个100 mL三颈瓶中,分别加入5 mmol 2-苯基-1,2,3-三唑醛或喹喔啉-2-甲醛(Scheme 1),N2气保护下加入40 mL甲苯,滴加0.4 mL Et3N,70 ℃下回流搅拌反应24 h。 溶液冷却至室温,过滤,将过滤后的产物用乙醚和二氯甲烷分别洗涤3次,产品烘干得灰白色粉末状固体1.3、1.4、1.1、1.2 g,分别记做配体L3、L4、L5、L6。 合成路线见Scheme 1。
在反应管中,加入配体L1~L6和金属盐NaVO3,在4 mL乙腈溶剂中搅拌1 h后加入反应底物苯1 mL和H2O2适量,磁力下搅拌一定时间,利用薄层色谱(TLC)与FeCl3检测进程。 反应液加入3 mL乙腈溶液萃取、取上清液加入适量无水硫酸镁干燥后进行气相色谱分析。
反应液先加入3 mL乙腈溶液萃取、取上清液加入10 g无水硫酸镁干燥后采用GC-14B气相色谱仪分析:RTX-5MS毛细管柱,载气为高纯N2气,FID检测,检测器温度320 ℃,进样口温度300 ℃,采用程序升温,柱温50 ℃保持3 min,以25 ℃/min升至300 ℃。
选取甲苯作为内标物,制作苯酚的标准曲线,使用气质联用定性检测反应产物为苯酚,同时检测到副产物为对苯二酚、邻苯二酚和对苯醌3种物质,之后我们得到:苯酚的线性方程 Y=-815.7+102357.5× B,相关系数 R=0.9997。 继而得到苯酚的产率和选择性( S为选择性)。
S(苯酚)/%=
2.1.1 X射线、BET和SEM表征 从图1 A可以看出,介孔分子筛MCM-41 A、修饰后的介孔分子筛C、E以及配体L6的晶面衍射特征峰(15°~30°)仍然存在,即样品保持了MCM-41孔壁的非晶特征,由于载体表面嫁接了有机基团和金属盐后其局部有序性降低,分子筛的特征峰有细微的下降;其中测试样品改性分子筛E(L6-NaVO3)的制备:取配体L6 0.005 g以及NaVO3 0.010 g于3 mL乙醇中磁力搅拌0.5 h过滤烘干。 由图1 B的小角XRD分析看出配体L6相对于MCM-41的六方晶相结构特征峰向大角度方向位移表明了其孔径一定程度缩小。 其余配体的相同表征基本类似,这里选取活性较高的配体L6进行分析。
配体L6经JW-BK静态氮吸附仪测得孔体积和原分子筛相比无变化,但孔径由4.6 nm缩小到了3.8 nm,比表面积由81.5 m2/g增加到99.3 m2/g。 这可能是席夫碱修饰后MCM-41微孔区域的比表面积增加,同时填充了分子筛的局部孔体系。图2为MCM-41( A)和固载席夫碱L6( B)的电子显微镜照片。 由图2可见,固载前后样品的颗粒形貌基本未变,但局部比表面积和颗粒堆积形成的空隙发生了变化。
 | 图2 分子筛固载席夫碱前( A)、后( B)的SEM照片Fig.2 SEM images of the sample before and after immobilization of Schiff base A.MCM-41; B:ligand L6 |
2.1.2 FT-IR的表征 如图3所示,所有样品的红外光谱均在1085、803和469 cm-1出现的吸收峰分别为MCM-41骨架Si—O—Si键的不对称伸缩振动峰、对称伸缩振动峰和弯曲振动峰;959 cm-1出现了相对较弱的振动峰归为Si—OH的伸缩振动;3446 cm-1处出现形成氢键的硅羟基伸缩振动吸收峰。 在红外谱中样品C(谱线 b在2985)在1635 cm-1处的吸收峰归属为C=N伸缩振动峰,表明喹喔啉醛已成功固载到分子筛上;而图中L6-NaVO3(谱线 e,制备方法如上), C=N伸缩振动峰移动到了1601 cm-1处[27],以此推断分子筛和金属盐发生了一定配合作用。
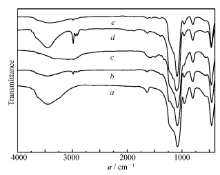 | 图3 配体L6及其前体的红外谱图Fig.3 IR patterns of ligand L6 and its precursors a.MCM-41 A; b.Cl-MCM-41 C; c.NH(CH2CH2NH2)-MCM-41 E; d. ligand L6; e.L6-NaVO3 |
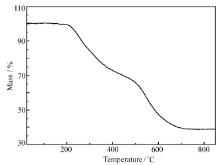
2.1.3 配体L6的TG曲线 如上图4所示,对于配体L6测试从室温升到850 ℃,208 ℃时开始失重,558 ℃后失重速度急剧下降,720 ℃出现平台,失重60.8%。 而MCM-41(A)分子筛由室温到720 ℃会有0.8%的失重,由此得到配体L的负载量为60.0%。
利用TLC和FeCl3溶液检测反应,结果(表1)表明,用配体L1、L2、L3(entries 1~3)催化反应,没有产物生成,而用配体L4、L5、L6催化反应时有微量的产物生成,说明一定程度增长碳链及使用喹喔啉醛可以提高催化剂对本反应的活性。
| 表1 不同配体对反应的影响 a Table 1 Effect of Ligand in the reaction a |
由于配体L4、L5和L6对此氧化反应有微弱的催化效果,尝试加入不同的金属盐共同催化反应。 用0.010 g配体L4、L5、L6与0.010 g金属盐共同催化氧化苯制取苯酚,结果如表2。 当单独用金属盐Fe2(SO4)3、NaVO3和Cu(OAc)2催化反应时,反应的收率仅为0.2%、0.3%和0.4%,而将金属与配体L4、L5、L6共同催化氧化反应时反应收率明显提高,其中配体L4、L5、L6与NaVO3共同催化时产率较高。 配体L4、L6合成中接入了喹喔啉醛,而配体L5、L6的碳链长度在此两相反应中较为合适,金属盐NaVO3与相转移配体的共同催化作用使得它的活性最优。
| 表2 金属盐对催化苯氧化反应的影响 a Table 2 Effect of metallic salt the reaction a |
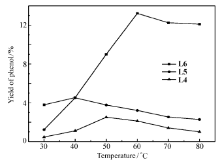
考察反应温度对反应的影响,温度由30~80 ℃,实验结果如图5所示,配体L6的催化性能明显高于配体L4和L5。 当反应温度为30 ℃时,苯酚的收率均较低;随着温度升高到60 ℃时,配体L6达到了较高收率13.2%,选择性92.7%;继续升高温度发现苯酚的收率和选择性逐渐下降,温度升高到80 ℃时,配体L6的苯酚收率下降至12.1%,选择性为90.2%。 这可能与过高的温度使双氧水分解并能够导致苯酚深度氧化有关。
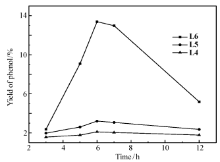
反应时间对苯羟基化反应的影响如图6所示。 配体L6的催化性能明显高于配体L4和L5。 当反应时间为3 h,配体L6仅得到2.4%的收率;延长反应时间至6 h可得到较高的产率(13.3%);继续延长反应时间,苯酚的收率随着时间的增长而下降,气相谱图中有较多杂峰,可能是产物苯酚氧化分解所致。 所以选择反应时间为6 h。
双氧水用量对苯羟基化反应的影响如图7所示。 配体L6的催化性能明显高于配体L4和L5。 随着H2O2用量的增加,苯酚的收率呈现先增加再降低的趋势。 当H2O2的用量为1 mL时,配体L6的苯酚收率为2.2%;当H2O2用量增加至2 mL时,配体L6的苯酚收率为19.2%。 所以选择H2O2的用量为2 mL。 同时也考察了加入H2O2的方式对实验结果的影响,发现分次加入H2O2更有利于苯酚的生成,这可能是由于分次加入可以减缓分解速度,从而增加了产物收率。 所以接下来选择60 ℃下6 h,2 mL H2O2,配体L6与NaVO3为催化剂做进一步的研究。
实验采用了乙腈、乙酸等溶剂测试不同溶剂对苯氧化反应的影响,实验结果如表3所示。 结果表明,不同的溶剂对产物的生成有较大的影响,其中当乙腈为溶剂时得到19.2%的收率,选择性为92.8%。 乙酸为溶剂时得到11.5%的收率,而三氯甲烷为溶剂时几乎没有产物。 这可能与溶剂对H2O2产生的羟基自由基的束缚作用不同有关,乙腈溶剂对羟基自由基的束缚作用很弱,所以溶剂为乙腈时催化效果较好。
| 表3 不同溶剂对苯羟基化反应的影响 a Table 3 Various solvent effect on the reaction a |
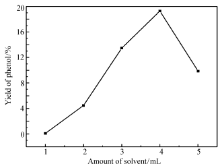
苯羟基化反应结果与反应溶剂用量的关系如图8所示。 随着溶剂乙腈用量的增加,苯酚的收率是先增加再降低的趋势。当乙腈的用量为4 mL时,苯酚的收率最高为19.3%;而继续增加乙腈的用量,苯酚的收率有明显的下降,乙腈用量为5 mL时,苯酚的收率为9.6%,这可能与溶剂用量过大导致催化剂、氧化剂等浓度较低致使产物收率降低有关。所以选择乙腈用量为4 mL。
为了得到更高的收率改变配体和NaVO3的比例以及用量,结果如表4所示。 当配体L6固定为0.010 g时,金属盐为0.010 g时,可得到19.3%的收率,之后随着NaVO3用量的增加收率反而下降,这可能与NaVO3促进苯羟基化反应的同时也加快了双氧水的分解有关;所以接下来固定金属盐为0.01 g来筛选配体的用量,最终确定比例为 m(L6): m(NaVO3)=0.005 g:0.010 g时,反应以达到较高的收率23.9%,选择性为92.5%。
| 表4 催化剂用量对苯羟基化反应的影响 a Table 4 Catalyst loadings effect on the reaction a |
初次使用的催化剂为 m(L6): m(NaVO3)=0.005 g:0.010 g,体系中的固体催化剂在反应完成后,利用离心机分离回收,再用乙酸乙酯洗涤两次,过滤烘干后继续催化反应。 当催化剂循环使用3次后,仍然具有很高的活性,实验结果如表5所示。 表明其活性下降只与配体有关,而反应过后的配体其孔结构可能被堵塞或者有一定程度的塌陷。 最后,又对反应进行扩大5倍量实验,得到产率23.1%和选择性93.2%。
| 表5 催化剂的循环使用 a Table 5 Reuse of catalyst a |
设计合成了一种新型的、廉价的一步氧化苯制苯酚的催化剂:以MCM-41介孔分子筛固载多氮杂环席夫碱同偏钒酸钠共为非均相催化剂(配体L6 0.005 g,NaVO3 0.010 g),乙腈(4 mL)为溶剂,30%的H2O2(2 mL)为氧化剂,对苯的直接催化氧化制苯酚反应具有良好的催化活性。 在优化的催化反应条件下,苯酚的收率达到23.9%,选择性为92.5%,且催化剂具有一定的功放效果和循环使用能力,具有一定工业应用的潜力。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|