以(5 R)-3-(4-溴-3-氟苯基)-5-羟甲基噁唑烷-2-酮为起始原料,在[PdCl2(dppf)]·CH2Cl2催化下与联硼酸频那醇酯反应得到硼化物,继而与5-溴-2-(2-甲基-2 H-四唑-5-基)吡啶进行Suzuki反应得到特地唑胺,收率82.9%。 分别考察了催化体系对硼化反应和Suzuki反应的影响,确定了较佳的反应条件。 特地唑胺与二苄基 N, N-二异丙基亚磷酰胺反应得到二苄基保护的磷酸特地唑胺,随后经Pd/C脱苄得到磷酸特地唑胺,总收率66.2%。
Tedizolid with a yield of 82.9% was synthesized by the Suzuki coupling reaction of 5-bromo-2-(2-methyl-2 H-tetrazol-5-yl)pyridine and (5 R)-3-(4-bromo-3-fluorophenyl)-5-(hydroxymethyl)-2-oxazolidinone which was prepared from bis(pinacolato)diboron using 1,1'-bis(diphenylphosphino)ferrocene-palladium(Ⅱ) dichloride dichloromethane complex as the catalyst. The effect of the catalytic system on the reaction of the borylation reaction and Suzuki reaction was investigated respectively, and the optimum reaction conditions were determined. Tedizolid phosphate was obtained by reaction of tedizolid with dibenzyl N, N-diisopropylphosphoramidite, and subsequent debenzylation with Pd/C. The total yield is 66.2%.
磷酸特地唑胺(Sivextro)由Cubist制药公司开发,是一种恶唑烷酮类抗菌素,适用于治疗金黄色葡萄球菌(包括耐甲氧西林菌株和甲氧西林敏感菌株)、各种链球菌及肠球菌等革兰阳性细菌引起的成人急性细菌性皮肤组织感染[1]。 磷酸特地唑胺是一种前药,在体内可被磷酸酶迅速转化为具有生物活性的特地唑胺。 和一代产品利奈唑胺相比,Sivextro对一些细菌的体外抑制活性要高4~16倍[2],安全性在一定程度上也有所提高。
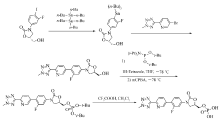
目前公开的磷酸特地唑胺的制备方法主要有以下两种: 1)该路线第一步反应使用有毒的有机锡试剂[3],第二步缩合反应制备关键中间体( R)-3-(4-(2-(2-甲基四唑-5-基)吡啶-5-基)3-氟苯基)-5-羟甲基噁唑烷-2-酮的收率低至26%,第三步反应制备( R)-[3-(4-(2-(2-甲基四唑-5-基)吡啶-5-基)-3-氟苯基)-2-氧-5-唑烷基]甲基磷酸双(四丁基酯)需-78 ℃下进行,且反应时间长。 因此,该路线总收率低,生产成本高,反应条件苛刻,生成周期长,不适合工业化生产[4,5,6]。
2)该路线以3-氟-4-溴苯胺为起始物料合成反应路线长,其中第二步硼化反应需在-72 ℃低温进行且得到的产物4-(苄氧羰基氨基)-2-氟苯硼酸的收率仅为66%并且很不纯,第四步成环反应操作步骤繁琐且反应时间长,最后一步磷酸化采用剧毒的发烟液体三氯氧磷。 因此,该路线也不适应工业化大规模生产[7,8]。
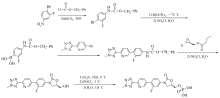
现有技术公开的磷酸特地唑胺的合成方法存在诸多缺陷,因此仍需研制磷酸特地唑胺的新方法。 本文研究磷酸特地唑胺的合成,采用化合物1[9,10,11]先于联硼酸频那醇酯得到硼化物化合物2,继而与化合物3[12,13,14]进行Suzuki反应得到特地唑胺,避免使用有机锡或锌化合物;为了避免产生二聚产物及氯代杂质等,我们采用二苄基 N, N-二异丙基亚磷酰胺作为磷酰化试剂,最后经脱苄得到磷酸特地唑胺,如Scheme 3所示。
AB SCIEX Triple TOF 4600型高分辨质谱仪(美国AB SCIEX公司);Waters 2487型高效液相色谱仪(美国Agilent公司)。 溶剂为分析纯试剂,(5 R)-3-(4-溴-3-氟苯基)-5-羟甲基噁唑烷-2-酮,5-溴-2-(2-甲基-2 H-四唑-5-基)吡啶,二苄基 N, N-二异丙基亚磷酰胺,联硼酸频那醇酯,Pd/C等均为工业品。
1.2.1 (5 R)-3-(4-溴-3-氟苯基)-5-羟甲基噁唑烷-2-酮硼化物(化合物2)的制备 250 mL反应瓶中加入DMSO(100 mL),(5 R)-3-(4-溴-3-氟苯基)-5-羟甲基噁唑烷-2-酮(10.00 g,34.5 mmol)、联硼酸频那醇酯(17.52 g,69.0 mmol)、 [1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(1.39 g,1.7 mmol)和醋酸钾(13.54 g,138.0 mmol),N2气保护下,升温至80 ℃,反应14 h。 停止加热,降至室温,加入500 mL水,乙酸乙酯(500 mL×3)萃取,合并有机层,所得有机相用饱和食盐水(400 mL×3)洗涤,无水硫酸钠干燥,抽滤浓缩,直接用于下步反应。
1.2.2 (5 R)-3-(4-(2-(2-甲基四唑-5-基)吡啶-5-基)3-氟苯基)-5-羟甲基噁唑烷-2-酮(化合物4)的制备 将上述步骤的浓缩产物加入到250 mL反应瓶中,加入1,4-二氧六环(100 mL)、5-溴-2-(2-甲基-2 H-四唑-5-基)吡啶(化合物3)(8.28 g,34.5 mmol)、[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(0.57 g,0.7 mmol)和碳酸铯水溶液(50 mL,含33.72 g碳酸铯,103.5 mmol),N2气保护下,升温至70 ℃,反应3 h,加入二氯甲烷(100 mL×3)萃取。 分离所得的有机相用饱和食盐水(100 mL)洗涤、无水硫酸钠脱水、过滤、真空浓缩并通过柱色谱纯化,得到10.60 g化合物4,收率82.9%,HPLC检测纯度为98.34%。
1H NMR(500 MHz,DMSO-d6), δ:8.93(s,1H),8.20(m,2H),7.72(m,2H),7.52(m,1H),5.18(t, J=5.6 Hz,1H),4.77(m,1H),4.48(s,3H),4.17(t, J=9.1 Hz,1H),3.92(m,1H),3.72(m,1H),3.61(m,1H);13C NMR(125 MHz,DMSO-d6), δ:163.75,159.19,154.15,149.24,144.98,140.43,136.91,131.48,130.69,121.92,118.48,113.89,105.29,73.31,61.51,45.91,39.52;HRMS m/z计算值C17H15FN6O3 [M+H]+:371.1262,实测值371.1264。
1.2.3 (5 R)-[3-(4-(2-(2-甲基四唑-5-基)吡啶-5-基)-3-氟苯基)-2-氧-5-唑烷基]甲基磷酸双(苄基酯)(化合物5)的制备 500 mL三口瓶中加入二氯甲烷(100 mL)、1 H-四氮唑(5.97 g,85.2 mmol)和化合物4(10.50 g,28.4 mmol),控温在30 ℃以下滴加二苄基 N, N-二异丙基亚磷酰胺(19.62 g,56.8 mmol),保持温度在25~30 ℃反应30 min。 降温至0~10 ℃,加入85%间氯过氧苯甲酸(8.08 g,39.8 mmol),5~10 ℃反应30 min。
反应液依次用饱和NaHCO3水溶液(40 mL×2)洗涤,饱和NaCl水溶液(40 mL)洗涤1次,无水硫酸钠干燥,过滤,浓缩,通过柱色谱纯化,得到14.89 g化合物5,收率83.1%,HPLC检测纯度为99.62%。
1H NMR(500 MHz,DMSO-d6), δ:8.93(s,1H),8.24(m,1H),8.19(m,1H),7.75(t, J=8.8 Hz,1H),7.67(m,1H),7.49(m,1H),7.34(m,10H),5.03(m,5H),4.49(s,3H),3.31(m,3H),3.92(m,1H);13C NMR(125 MHz,DMSO-d6), δ:163.81,159.23,153.75,149.34,145.07,140.09,137.08,135.78,131.50,130.75,128.36,127.73,122.04,118.80,114.06,105.46,70.98,68.74,67.29,45.70,39.53;HRMS m/z计算值C31H28FN6O6P [M+H]+:631.1865,实测值631.1852。
1.2.4 磷酸特地唑胺的制备 在2 L反应瓶中加入甲醇(1000 mL)、化合物5(12.80 g,20.3 mmol)和10%Pd/C(50%水,1.28 g),50 ℃常压加氢反应12 h,过滤,蒸干,得到8.78 g磷酸特地唑胺,收率96.1%,HPLC检测纯度为99.66%。
1H NMR(500 MHz,DMSO-d6), δ:8.94(s,1H),8.21(m,2H),7.72(m,2H),7.52(m,1H),4.99(m,1H),4.50(s,3H),4.25(t, J=9.3 Hz,1H),4.17(m,1H),4.10(m,1H),3.95(m,1H);13C NMR(125 MHz,DMSO-d6), δ:163.85,159.29,153.93,149.38,145.07,140.29,137.08,131.56,130.87,122.04,118.76,114.08,105.51,71.47,65.46,45.83,39.55;HRMS m/z计算值C17H16FN6O6P [M+H]+:451.0926,实测值451.0927。
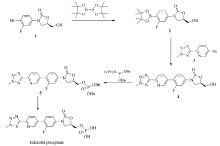
为了避免使用有机锡或锌化合物,采用(5 R)-3-(4-溴-3-氟苯基)-5-羟甲基噁唑烷-2-酮作为起始物料,通过和联硼酸频那醇酯反应得到相应硼化物2,继而参与Suzuki反应得到特地唑胺。 首先,对硼化反应条件进行了优化。
由表1可见,不加配体,Pd(OAc)2为催化剂,基本不反应(entry 1);引入PPh3配体,催化活性提高,反应收率为10.2%(entry 2);换用dppf配体,收率进一步提高至25.3%(entry 3);改用DMF溶剂,收率下降至23.2%(entry 4);使用PdCl2/dppf催化体系,收率升至56.1%(entry 5);不加配体,使用[PdCl2(dppf)]·CH2Cl2为催化剂,收率最高为86.3%(entry 6)。 综上所述,筛选出的最佳催化剂体系为:不加配体,使用[PdCl2(dppf)]·CH2Cl2作为催化剂,DMSO为溶剂。
| 表1 硼化反应条件的优化 a Table 1 Optimization of Borylation reaction conditions a |
将(5 R)-3-(4-溴-3-氟苯基)-5-羟甲基噁唑烷-2-酮和联硼酸频那醇酯反应得到的相应硼化物2与5-溴-2-(2-甲基-2 H-四唑-5-基)吡啶3进行Suzuki反应得到特地唑胺,并对Suzuki反应条件进行了优化。
| 表2 Suzuki反应条件的优化 a Table 2 Optimization of Suzuki reaction conditions a |
表2结果显示,分别考察了Pd(OAc)2与PdCl2与不同配体组成对反应的影响(entries 1~6),使用PdCl2/dppf催化体系,收率最高为78.6%(entry 6);不加配体,使用[PdCl2(dppf)]·CH2Cl2为催化剂,收率为93.1%(entry 7);进一步考察了常用碱对反应的影响(entries 7~11),结果显示Cs2CO3为最佳碱。 综上所述,筛选出的最佳催化剂体系为:不加配体,使用[PdCl2(dppf)]·CH2Cl2作为催化剂,Cs2CO3作为碱。
本文所报道方法采用(5 R)-3-(4-溴-3-氟苯基)-5-羟甲基噁唑烷-2-酮为起始原料与联硼酸频那醇酯反应得到硼化物,继而与5-溴-2-(2-甲基-2 H-四唑-5-基)吡啶进行Suzuki反应得到特地唑胺,避免使用有机锡或锌化合物,为了避免产生二聚产物及氯代杂质等,采用二苄基 N, N-二异丙基亚磷酰胺作为磷酰化试剂,最后经Pd/C脱苄得到磷酸特地唑胺,总收率66.2%。 该磷酸特地唑胺的合成方法反应条件温和(无需超高温或超低温),收率高,后处理方便,有利于工业化生产。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|