通过原子经济的Mannich反应实现了磺胺嘧啶、1-萘乙酮与芳香醛三组分的连接,直接合成了16个含有磺胺嘧啶结构单元的未见报道的 β-氨基酮;所得化合物经1H NMR、13C NMR、HRMS和MS等技术手段确证其结构。 生物活性测试结果显示,在17.04~19.69 nmol/L浓度范围内,所有目标分子的 α-葡萄糖苷酶抑制活性很弱,但部分目标分子的过氧化物酶体增殖物激活受体反应元件(PPRE)激动活性较好,最高达到了52%。
Sixteen new β-amino ketones containing sulfadiazine moiety have been directly synthesized through atom-economic Mannich reaction of sulfadiazine with 1-acetonaphthone and some aromatic aldehydes. The chemical structures of these obtained compounds were identified by1H NMR,13C NMR, and HRMS. The biological assay results show that all obtained compounds in the concentration range of 17.04~19.69 nmol/L possess very weak α-glucosidase inhibitory activities, while some compounds can activate peroxisome proliferator-activated receptor response element(PPRE) moderately, of which one exhibits the strongest activity(52%).
统计数据显示,糖尿病已成为全球发病率和死亡率最高的5种疾病之一,因其严重威胁人类健康而备受世人关注[1]。 糖尿病是由于胰岛素绝对或相对不足以及细胞对胰岛素敏感性降低,引起糖、蛋白、脂肪、电解质等一系列代谢紊乱的临床综合征。 常用的抗糖尿病药物有促胰岛素分泌药物[2]、双胍类、噻唑烷二酮类(TZDs)等胰岛素增敏剂[3,4]、 α-葡萄糖苷酶抑制剂[5]等。 上述一线临床药物具有明确的糖尿病控制和治疗作用,但若长期大剂量服用这些药物,则存在由 α-葡萄糖苷酶抑制剂引起的腹泻腹痛[6]、TZDs类药物导致的肝毒性[7]以及磺酰脲类药物原发效应较差[8] 等副作用或不足。 因此,寻找高效低毒的新型降糖药物仍然是糖尿病药物研发的重要课题。
β-氨基酮不仅是重要的有机合成中间体[9],而且具有抗炎[10]、抗菌[11]、抗结核[12]、止痛[13]等广泛的生物活性。 近20年来,本课题组致力于新型 β-氨基酮的合成及其生物活性研究,在发现某些 β-氨基酮具有抗肿瘤活性[14]、雄激素受体调节活性[15]后,又陆续发现某些 β-氨基酮具有明确的抗糖尿病活性[16,17]。 上述结果激励我们继续合成新的 β-氨基酮并研究其生物活性。
苯磺酰胺结构单元表现出多种生物活性,已被广泛引入抗菌[18]、降糖[19]、利尿[20]、 α1-肾上腺素受体拮抗[21]、HIV-1蛋白酶抑制[22]以及骨质疏松[23]等活性分子之中。 目前大量使用的磺酰脲类促胰岛素分泌药物,如氯磺丁脲、格列齐特、格列美脲等[2]结构中均含有苯磺酰胺结构单元。 磺胺嘧啶(Sulfadiazine,3)是治疗全身感染的中效磺胺类药物,其结构类似于磺酰脲类降糖药物中的磺酰脲结构。 本课题组也发现,含有苯磺酰胺结构单元的多种类型的分子具有一定的抗糖尿病活性[24,25,26,27,28]。 生物活性测定还发现,含有萘环(较大的疏水性基团)的 β-氨基酮,显示较好的 α-葡萄糖苷酶抑制活性和过氧化物酶体增殖物激活受体反应元件(PPRE)激动活性[16,17,27,28]。
基于上述研究结果,作者设想将磺胺嘧啶和萘环结构单元引入 β-氨基酮分子之中,并进行抗糖尿病相关的生物活性研究,希望发现高活性分子。
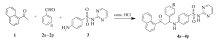
借助高原子经济性的Mannich反应,通过醛组分将磺胺嘧啶、1-萘乙酮直接引入 β-氨基酮之中,即可得到设计的目标分子。 通过系统的反应条件探索,作者成功实现了上述三组分的直接Mannich反应(Scheme 1),并对得到的系列化合物进行了 α-葡萄糖苷酶抑制活性和PPRE激动活性研究。
AV-300型超导核磁共振仪(瑞士布鲁克拜厄斯宾有限公司),TMS为内标,DMSO-d6为溶剂;X-6型精密显微熔点测定仪(北京福凯仪器有限公司);Agilent 1946B型MS质谱仪(美国安捷伦科技有限公司,ESI MS);HRMS高分辨质谱仪(美国Bruker公司,MALDI-TOF,Bruker Daltonics Data Analysis 3.2);实验所用均为市售化学纯试剂或市售分析纯试剂。
称取2 mmol芳香醛于50 mL圆底烧瓶中,加入2~4 mL无水乙醇,溶解后加入0.500 g(2 mmol)磺胺嘧啶,补加6~12 mL无水乙醇。 在30 ℃下电磁搅拌,约1 h后加入0.340 g(2 mmol)1-萘乙酮,滴加催化量浓盐酸,继续在30 ℃下电磁搅拌。 TLC监测反应进程。反应毕,置于冰箱(4 ℃)中过夜。 次日抽滤,滤饼醇洗(2 mL×3)后,分散于pH值7~8的Na2CO3水溶液中,室温搅拌2 h,冰箱静置过夜。 次日抽滤,滤饼水洗至中性,抽干得粗品或纯品。 粗品再经Na2CO3水溶液分散、乙醇分散或重结晶,干燥后得到目标化合物4a~4p。
4-[3-(1-萘基)-3-氧代-1-(4-硝基苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4a):收率14.9%,mp 189.5~190.8 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.55~3.62、3.73~3.76(m,2H,CH2),5.29(br s,1H,CH),6.62(d, J=8.40 Hz,2H,Ar—H),7.00(t, J=4.45 Hz,1H,X),7.36(d, J=7.26 Hz,1H,NH),7.54~7.57(m,2H,Ar—H),7.60~7.65(m,3H,Ar—H),7.76(d, J=8.16 Hz,2H,Ar—H),7.98~8.00(m,1H,Ar—H),8.12~8.15(m,2H,Ar—H),8.19(d, J=8.12 Hz,2H,Ar—H),8.41(d, J=5.65 Hz,1H,Ar—H),8.47(d, J=4.62 Hz,2H,X),11.32(s,1H,SO2NH);13C NMR(75MHz,DMSO-d6), δ:201.2(C=O),159.3,158.1,152.0,147.6,135.9,134.4,133.7,130.8,130.5,129.4,129.0,128.7,127.3,127.1,126.3,125.8,124.7,116.7,112.4(Ar,X),53.2,49.6;ESI-MS:554.1([M+1]+,100%);HRMS计算值C29H23N5O5S [M+Na]+ 576.1312,实测值576.1316。
4-[3-(1-萘基)-3-氧代-1-(3-硝基苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4b):收率17.5%,mp 185.3~186.6 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.56~3.61、3.74~3.83(m,2H,CH2),5.31(br s,1H,CH),6.65(d, J=8.25 Hz,2H,Ar—H),6.99 (t, J=4.51 Hz,1H,X),7.37(d, J=7.71 Hz,1H,NH),7.52~7.64(m,6H,Ar—H),7.97(d, J=6.81 Hz,2H,Ar—H),8.06~8.14(m,3H,Ar—H),8.36~8.40(m,2H,Ar—H),8.45(d, J=4.35 Hz,2H,X),11.32(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:200.4(C=O),158.2,157.2,150.9,147.9,145.5,135.1,133.4,132.7,129.6,129.4,128.4,127.7,126.4,126.2,125.4,124.8,122.2,121.5,115.6,111.5(Ar,X),52.1,48.9;ESI-MS:554.1([M+1]+,100%);HRMS计算值C29H23N5O5S [M+Na]+576.1312,实测值576.1314。
4-[3-(1-萘基)-3-氧代-1-(2,4-二氯苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4c):收率13.5%,mp 197.2~198.5 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.44~3.50、3.59~3.68(m,2H,CH2),5.41(m,1H,CH),6.48(d, J=8.31 Hz,2H,Ar—H),7.01(t, J=4.42 Hz,1H,X),7.31~7.38(m,2H,Ar—H,NH),7.49~7.65 (m,7H,Ar—H),7.97~8.00(m,1H,Ar—H),8.13~8.20(m,2H,Ar—H),8.43(br s,1H,Ar—H),8.47(d, J=4.65 Hz,2H,X),11.34 (s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:200.2(C=O),158.3,157.2,153.0,138.9,133.5,132.8,132.6,129.9,129.7,129.5,129.4,129.2,129.0,128.6,128.5,127.9,127.8,126.4,125.4,124.8,115.6,112.2,111.2,49.6,47.2;ESI-MS: 577.0([M]+,100%),579.0([M+2]+,70%);HRMS计算值C29H22Cl2N4O3S [M+Na]+ 599.0682,实测值599.0675。
4-[3-(1-萘基)-3-氧代-1-(3,4-二氯苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4d):收率38.5%,mp 177.6~180.4 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.50~3.57、3.67~3.76(m,2H,CH2),5.15(br s,1H,CH),6.62(d, J=8.40 Hz,2H,Ar—H),7.00(t, J=4.71 Hz,1H,X),7.24(d, J=7.51 Hz,1H,NH),7.46(d, J=8.21 Hz,1H,Ar—H),7.53~7.60(m,4H,Ar—H),7.63(d, J=7.74 Hz,2H,Ar—H),7.97~8.00(m,1H,Ar—H),8.12~8.21(m,3H,Ar—H),8.39 (d, J=5.33 Hz,1H,Ar—H),8.46(d, J=4.71 Hz,2H,X),11.31(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:200.5(C=O),158.3,157.2,151.0,144.3,141.9,135.1,133.4,132.6,131.1,130.6,129.6,129.4,128.9,128.4,127.7,127.1,126.4,125.3,125.2,124.9,124.8,115.6,111.5,51.7,48.8;ESI-MS:577.0([M]+,100%),579.0([M+2]+,70%);HRMS计算值C29H22Cl2N4O3S [M+Na]+ 599.0682,实测值599.0679。
4-[3-(1-萘基)-3-氧代-1-(3-氟苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4e):收率13.1%,mp 186.2~189.1 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.45~3.57,3.66~3.73(m,2H,CH2),5.14(br s,1H,CH),6.58(d, J=8.60 Hz,2H,Ar—H),7.01~7.29(m,4H,X,Ar—H,NH),7.35(d, J=7.49 Hz,1H,Ar—H),7.58~7.68 (m,6H,Ar—H),7.98~8.00(m,1H,Ar—H),8.10~8.16(m,3H,Ar—H),8.48(d, J=4.75 Hz,2H,X),11.29 (s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:200.7(C=O),160.6,158.2,157.4,151.1,146.1,133.4,132.5,130.4,130.3,129.7,129.4,128.4,128.1,127.6,126.3,125.3,124.7,122.7,115.3,113.7,113.3,112.1,111.3,52.3,49.1;ESI-MS:527.1([M+1]+,100%);HRMS计算值C29H23FN4O3S [M+Na]+ 549.1367,实测值549.1371。
4-[3-(1-萘基)-3-氧代-1-(4-氯苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4f):收率25.6%,mp 188.6~190.4 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.47~3.54、3.66~3.74(m,2H,CH2),5.13(br s,1H,CH),6.58(d, J=8.64 Hz,2H,Ar—H),7.00(t, J=4.78 Hz,1H,X),7.26(d, J=7.51 Hz,1H,NH),7.36(d, J=8.25 Hz,2H,Ar—H),7.48(d, J=8.28 Hz,2H,Ar—H),7.52~7.57(m,2H,Ar—H),7.59~7.62(m,2H,Ar—H),7.63(s,1H,Ar—H),7.98(m,1H,Ar—H),8.10(t, J=8.99 Hz,2H,Ar—H),8.36(m,1H,Ar—H),8.47(d, J=4.77 Hz,2H,X),11.30(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:200.7(C=O),158.3,157.2,151.2,141.9,135.2,133.4,132.6,131.6,129.8,129.5,129.4,128.6,128.4,128.2,127.6,126.4,125.8,125.4,124.8,115.6,112.1,111.3,52.1,49.1;ESI-MS:543.1([M+1]+,100%);HRMS计算值C29H23ClN4O3S [M+Na]+ 565.1072,实测值565.1067。
4-[3-(1-萘基)-3-氧代-1-(3-氯苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4g):收率32.4%,mp 168.9~171.1 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.49~3.56、3.67~3.72(m,2H,CH2),5.15(br s,1H,CH),6.61(d, J=8.64 Hz,2H,Ar—H),7.00 (t, J=4.70 Hz,1H,X),7.27~7.34(m,3H,Ar—H,NH),7.43(d, J=7.47 Hz,1H,Ar—H),7.54~7.64(m,6H,Ar—H),7.98~8.00(m,1H,Ar—H),8.10~8.16(m,3H,Ar—H),8.47(d, J=4.74 Hz,2H,X),11.31 (s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6). δ:200.6(C=O),158.3,157.2,151.1,145.6,135.2,132.8,130.4,129.5,129.4,129.2,128.5,128.4,128.3,127.9,127.7,127.1,126.6,126.4,125.5,125.4,124.8,115.6,111.4,52.2,49.1;ESI-MS:543.1([M+1]+,100%);HRMS计算值C29H23ClN4O3S [M+Na]+ 565.1072,实测值565.1070。
4-[3-(1-萘基)-3-氧代-1-(2-氯苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4h):收率19.3%,mp 195.7~197.2 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.45~3.50、3.58~3.67(m,2H,CH2),5.45(br s,1H,CH),6.48(d, J=8.46 Hz,2H,Ar—H),7.01(t, J=4.67 Hz,1H,X),7.28~7.30(m,2H,Ar—H),7.37(d, J=7.39 Hz,1H,NH),7.46~7.58(m,4H,Ar—H),7.62~7.64(m,3H,Ar—H),7.97~8.00(m,1H,Ar—H),8.15(t, J=7.71 Hz,2H,Ar—H),8.41(d, J=5.56 Hz,1H,Ar—H),8.47(d, J=4.72 Hz,2H,X),11.31 (s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:200.5(C=O),158.2,157.1,150.9,139.6,134.9,133.4,132.7,131.8,129.6,128.9,128.4,128.3,127.7,126.4,126.2,125.3,124.7,115.6,111.1(Ar,X),49.8,47.5;ESI-MS:543.1([M+1]+,100%);HRMS计算值C29H23ClN4O3S [M+Na]+ 565.1072,实测值565.1070。
4-[3-(1-萘基)-3-氧代-1-(3-甲氧基苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4i):收率37.6%,mp 186.7~188.1 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.45~3.51、3.65~3.69(m,2H,CH2),3.72(s,3H,OCH3),5.08(br s,1H,CH ),6.59(d, J=8.25 Hz,2H,Ar—H ),6.77(d, J=7.56 Hz,1H,NH),7.01(m,3H,Ar—H),7.22(t, J=7.68 Hz,2H,Ar—H),7.52~7.55(m,2H,Ar—H),7.61(m,3H,Ar—H),7.79~7.99(m,1H,Ar—H),8.08~8.14(m,2H,Ar—H),8.36(d, J=7.83 Hz,1H,Ar—H),8.47(d, J=4.29 Hz,2H,X),11.30(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:200.9(C=O),159.4,158.2,157.2,151.4,144.5,135.4,133.4,132.4,129.5,129.4,128.4,128.1,127.6,126.3,125.6,125.4,124.8,118.7,115.5,112.5,112.3,111.3(Ar,X),54.9,52.8,49.4;ESI-MS:539.2([M+1]+,100%);HRMS计算值C30H26N4O4S [M+Na]+ 561.1567,实测值561.1561。
4-[3-(1-萘基)-3-氧代-1-(4-溴苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4j):收率36.9%,mp 191.8~194.8 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.46~3.53、3.65~3.68 (m,2H,CH2),5.11(br s,1H,CH),6.58(d, J=8.58 Hz,2H,Ar—H),7.00(t, J=4.79 Hz,1H,X),7.26(d, J=7.48 Hz,1H,NH),7.42(d, J=8.31 Hz,2H,Ar—H),7.46~7.56(m,2H,Ar—H),7.60~7.67(m,4H,Ar—H),7.78(d, J=8.42 Hz,1H,Ar—H),7.96~8.17(m,3H,Ar—H),8.33~8.38(m,1H,Ar—H),8.47(d, J=4.78 Hz,2H,X),11.30(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:200.7(C=O),158.2,157.2,151.2,142.3,133.4,132.5,131.9,131.3,130.7,129.5,129.4,128.9,128.6,128.4,128.2,127.6,126.4,125.4,124.9,120.1,115.6,111.4,52.2,49.1;ESI-MS:589.0([M+2]+,100%),587.0([M]+,90%);HRMS计算值C29H23BrN4O3S [M+Na]+ 609.0567,实测值609.0564。
4-[3-(1-萘基)-3-氧代-1-苯基丙氨基]- N-(2-嘧啶基)苯磺酰胺(4k):收率26.6%,mp 197.3~199.1 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.47~3.52、3.66~3.74(m,2H,CH2),5.11(br s,1H,CH),6.58(d, J=8.04 Hz,2H,Ar—H),7.00(br s,1H,X),7.21~7.33(m,4H,Ar—H,NH),7.45(d, J=7.47 Hz,2H,Ar—H),7.53(m,2H,Ar—H),7.60(m,3H,Ar—H),7.97~7.98(m,1H,Ar—H),8.07~8.14(m,2H,Ar—H),8.35(d, J=8.11 Hz,1H,Ar—H),8.47(d, J=4.38 Hz,2H,X),11.28(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:201.9(C=O),159.3,158.1,152.3,143.8,136.4,134.4,133.5,130.5,129.5,128.6,128.0,127.6,127.4,126.5,126.4,125.8,116.5,112.2(Ar,X),53.7,50.4;ESI-MS: 509.1([M+1]+,100%);HRMS计算值C29H24N4O3S [M+Na]+ 531.1461,实测值531.1457。
4-[3-(1-萘基)-3-氧代-1-(3-甲基苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4l):收率49.5%,mp 187.3~188.5 ℃;1H NMR(300 MHz,DMSO-d6), δ:2.27(s,3H,CH3),3.42~3.48、3.65~3.74(m,2H,CH2),5.06(br s,1H,CH),6.58(d, J=8.31 Hz,2H,Ar—H),7.00(m,2H,X,Ar—H),7.15~7.23(m,4H,Ar—H,NH),7.54(t, J=6.69 Hz,2H,Ar—H),7.60(m,3H,Ar—H),7.98(d, J=7.11 Hz,1H,Ar—H),8.07~8.13(m,2H,Ar—H),8.33(d, J=7.59 Hz,1H,Ar—H ),8.46(d, J=4.29 Hz,2H,X),11.28(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:201.1(C=O),158.3,157.2,151.4,142.8,137.6,135.4,133.4,132.5,129.5,129.4,128.4,128.1,127.8,127.6,127.2,126.4,125.4,124.8,123.6,115.6,111.3,52.8,49.5,21.1;ESI-MS:523.1([M+1]+,100%);HRMS计算值C30H26N4O3S [M+Na]+ 545.1618,实测值545.1615。
4-[3-(1-萘基)-3-氧代-1-(4-甲基苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4m):收率29.9%,mp 202.9~205.8 ℃;1H NMR(300 MHz,DMSO-d6), δ:2.23(s,3H,CH3),3.43~3.50、3.63~3.72(m,2H,CH2),5.06(m,1H,CH),6.57(d, J=8.43 Hz,2H,Ar—H),7.00(t, J=4.48 Hz,1H,X),7.10(d, J=7.51 Hz,2H,Ar—H),7.22(d, J=7.48 Hz,1H,NH),7.32(d, J=7.71 Hz,2H,Ar—H),7.52~7.54,7.56~7.61(m,5H,Ar—H),7.97~7.99(m,1H,Ar—H),8.07(d, J=7.14 Hz,1H,Ar—H),8.12(d, J=8.17 Hz,1H,Ar—H),8.34(d, J=8.14 Hz,1H,Ar—H),8.47(d, J=4.64 Hz,2H,X),11.28(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:201.1(C=O),158.3,157.2,151.4,139.8,136.2,135.5,133.4,132.5,129.5,129.1,128.4,128.1,127.6,126.5,126.4,125.4,124.8,115.6,111.3,52.5,49.5,20.7;ESI-MS:523.1([M+1]+,100%);HRMS计算值C30H26N4O3S [M+Na]+ 545.1618,实测值545.1615。
4-[3-(1-萘基)-3-氧代-1-(4-甲氧基苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4n):收率11.0%,mp 190.4~191.4 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.43~3.50、3.63~3.66(m,2H,CH2),3.69(s,3H,OCH3),5.05(m,1H,CH),6.58(d, J=8.43 Hz,2H,Ar—H),6.86(d, J=8.13 Hz,2H,Ar—H),7.00(t, J=4.51 Hz,1H,X),7.2(d, J=7.53 Hz,1H,NH),7.36(d, J=8.24 Hz,2H,Ar—H),7.52~7.54(m,2H,Ar—H),7.60(d, J=8.05 Hz,2H,Ar—H),7.98(d, J=7.80 Hz,1H,Ar—H),8.07(d, J=7.12 Hz,1H,Ar—H),8.12(d, J=8.18 Hz,2H,Ar—H),8.33(d, J=8.02 Hz,1H,Ar—H),8.47(d, J=4.53 Hz,2H,X),11.29(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:202.2(C=O),159.2,158.1,152.4,136.5,135.6,134.4,133.4,130.4,129.3,129.0,128.7,128.5,127.4,126.4,125.8,116.6,114.8,112.3(Ar,X),55.9,53.2,50.3;ESI-MS:539.1([M+1]+,100%);HRMS计算值C30H26N4O4S [M+Na]+ 561.1567,实测值561.1566。
4-[3-(1-萘基)-3-氧代-1-(4-正丁氧基苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4o):收率18.0%,mp 165.7~167.2 ℃;1H NMR(300 MHz,DMSO-d6), δ:0.90(t, J=7.26 Hz,3H,CH3),1.36~1.43(m,2H,CH2),1.62~ 1.67(m,2H,CH2),3.42~3.49、3.62~3.71(m,2H,CH2),3.89(t, J=6.25 Hz,2H,OCH2),5.04(br s,1H,CH),6.57(d, J=8.58 Hz,2H,Ar—H),6.84(d, J=8.34 Hz,2H,Ar—H),6.99(t, J=4.69 Hz,1H,X),7.19(d, J=7.60 Hz,1H,NH),7.33(d, J=8.34 Hz,2H,Ar—H),7.51~7.56(m,3H,Ar—H),7.60(d, J=8.22 Hz,2H,Ar—H),7.98(d, J=8.32 Hz,2H,Ar—H),8.05(d, J=7.09 Hz,1H,Ar—H),8.11(d, J=8.22 Hz,1H,Ar—H),8.32(d, J=7.87 Hz,1H,Ar—H),8.46(d, J=4.66 Hz,2H,X),11.28(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:201.2(C=O),158.3,157.7,157.2,153.1,151.4,135.5,134.4,133.4,132.4,129.8,129.5,129.4,128.4,128.0,127.7,127.6,126.4,125.4,124.8,115.5,114.3,112.1,111.3,67.0,52.2,49.5,30.8,18.7,13.7;ESI-MS:581.2([M+1]+,100%);HRMS计算值C33H32N4O4S [M+Na]+ 603.2036,实测值603.2033。
4-[3-(1-萘基)-3-氧代-1-(3,4-二氧亚甲基苯基)丙氨基]- N-(2-嘧啶基)苯磺酰胺(4p):收率20.5%,mp 202.1~205.1 ℃;1H NMR(300 MHz,DMSO-d6), δ:3.42~3.47、3.61~3.67(m,2H,CH2),5.02(br s,1H,CH),5.95(d, J=6.87 Hz,2H,OCH2O),6.59(d, J=8.46 Hz,2H,Ar—H),6.81(d, J=7.89 Hz,1H,Ar—H),6.91(d, J=7.90 Hz,1H,Ar—H),7.00~7.05(m,2H,X,Ar—H),7.16(d, J=7.26 Hz,1H,NH),7.52~7.61(m,5H,Ar—H),7.98(d, J=8.13 Hz,1H,Ar—H),8.07(d, J=7.17 Hz,1H,Ar—H),8.12(d, J=8.13 Hz,1H,Ar—H),8.33(d, J=8.43 Hz,1H,Ar—H),8.47(d, J=4.71 Hz,2H,X),11.28(s,1H,SO2NH);13C NMR(75 MHz,DMSO-d6), δ:201.1(C=O),158.3,157.2,151.3,147.4,146.2,136.8,135.5,133.4,132.5,129.5,129.4,128.4,128.1,127.6,,126.4,125.4,124.8,123.5,119.9,115.6,111.4,108.1,107.0,100.9,52.5,49.5;ESI-MS:553.1([M+1]+,100%);HRMS计算值C30H24N4O5S [M+Na]+ 575.1360,实测值575.1352。
2.1.1 取代基R对反应的影响 合成结果表明,芳香醛环上取代基的位置及性质对反应有明显影响:1)间位取代的芳香醛参与的反应明显比对位取代的收率高;2)含弱供电子基团(CH3)和弱钝化基团(Br)的芳香醛比含强供电子基团(OCH3)和强吸电子基团(NO2)的芳香醛参与的反应收率高;3)芳香醛中取代基的供电子能力越强,反应收率越低,有强供电子基团的对(间)羟基苯甲醛则不发生反应;4)芳香醛取代基的吸电子能力越强,反应收率越低。 这可能与中间产物Schiff 碱生成的难易程度和稳定性密切相关。 另外,2-氯苯甲醛和2,4-二氯苯甲醛参与的反应,不仅反应时间长而且收率低,表明空间位阻抑制反应的的进行。
2.1.2 反应条件对反应的影响 影响Mannich反应的外因主要有溶剂、温度、催化剂和投料比等。 实验发现,原料磺胺嘧啶在很多溶剂中的溶解度均很小,导致反应效果很差。 为了改善反应,以化合物4k的合成为模型实验,筛选了乙醇、异丙醇、正丙醇、正丁醇、乙腈及DMF等溶剂,发现在乙醇、DMF中反应收率相对较好(分别为55%,pH=3,88 h;45%,pH=3,89 h),在其它溶剂中的收率低于15%。 增加溶剂的用量促进磺胺嘧啶完全溶解,但溶剂量的增加导致其他反应物浓度的降低,反应速率反而减慢,没有达到提高收率的目的。 因此,选用乙醇为最佳反应溶剂。
多数芳香醛、芳香胺和芳烷酮的Mannich反应在室温或稍低于室温一般可以很好地进行[29,30,31,32]。 本系列反应绝大多数也能在30 ℃左右发生,但是反应时间较长收率不高。 为了缩短反应时间和提高收率,作者对部分芳香醛参与的反应进行了反应温度的优化(表 1)。 实验发现,当温度低于25 ℃时反应效果更差甚至不反应,而当温度升高到50 ℃时会有明显的杂质生成,收率也没有明显改观。 数据表明,含供电子取代基(—OR)的芳香醛参与的反应,温度升高收率降低;含吸电子取代基(—NO2)的芳香醛参与的反应,温度升高收率略有提高(表1)。 结果表明,该系列反应适合在常温条件下进行。
| 表1 温度对目标化合物合成的影响 Table 1 Effect of temperature on the synthesis of some target compounds |
另外,作者还对反应的催化剂以及投料比进行优化。 作者试用了浓盐酸、H3PO4、无水FeCl3、I2等催化剂,发现无水FeCl3、H3PO4几乎不能催化本系列Mannich反应的发生,I2可以催化该系列反应的发生但催化效果很差。 比较而言,价廉易得的浓盐酸能较好地催化该系列Mannich反应的发生,加之具有用量少、后处理方便等优点,因此本系列Mannich反应适合在浓盐酸的催化下进行。
尝试通过改变反应物比例提高反应收率,当增大磺胺嘧啶的投料比时,转化率不仅没有明显提高,反而因为磺胺嘧啶很难除尽而给提纯带来困难;当增加醛酮组分的投料比时,虽然磺胺嘧啶的转化率略有提高、后处理相对容易,但收率没有明显改善。 除去反应中残余的磺胺嘧啶具有挑战性,在pH值7~8的Na2CO3水溶液中,磺胺嘧啶有一定的溶解性而产物几乎不溶。 因此,将粗产物在pH值7~8的Na2CO3水溶液中分散数小时,再静置、抽滤、洗涤,基本上可除去未反应的磺胺嘧啶组分,实现产物的提纯。
α-葡萄糖苷酶和过氧化物酶体增殖物激活受体(PPAR)是糖尿病药物的两个作用靶标,目前均有针对这些靶标的上市药物。 一般而言,某一分子的 α-葡萄糖苷酶抑制活性[16,27,28]和/或PPAR激动活性[17,24,25,27,28]越强,其抗糖尿病活性越强。 化合物4的 α-葡萄糖苷酶的抑制活性和PPRE激动活性如表2所示,芳香醛4位有取代基的分子的活性较对应3位有取代基者活性稍好,但是这些分子的 α-葡萄糖苷酶的抑制活性整体较弱(这可能与分子结构类型相关)。
| 表2 β-氨基酮生物活性数据 Table 2 Biological activities of β-amino ketones containing sulfadiazine moiety |
然而在相同浓度下,该系列分子总体具有较好的PPRE激动活性,其中化合物4k相对活性达到52.14%。 从目标分子结构上看,分子之间的差别主要是由取代基R的电性、位置和空间体积不同所引起的,那么该系列分子PPRE活性强弱的差别,也就主要取决于取代基R。 数据分析显示:1)取代基处于2或3位的化合物的PPRE活性普遍好于取代基处于4位者,说明芳环上4位存在取代基时会导致活性降低; 2)芳环上的4位取代基R体积越大活性越低。 上述结果均表明,芳环上取代基的位置及体积是决定该系列化合物PPRE激动活性的关键因素。 这可能与目标分子和PPRE靶点结合性能相关[33],亦即当取代基R处于芳环上4位且体积较大时,目标分子与PPRE受体腔不匹配,难以良好结合,导致活性降低。 本文所涉及的化合物的结构-活性关系还有待进一步研究。
采用“分段投料一锅法”实现了磺胺嘧啶、芳香醛和萘乙酮的Mannich反应,成功合成了16个化学结构新颖的 β-氨基酮;通过在Na2CO3溶液中分散除杂,建立了该类分子的独特纯化方法;目标分子的 α-葡萄糖苷酶的抑制活性很差,但具有一定的PPRE激动活性,其中化合物4k的活性最好,达到52.14%,值得进一步研究。
致谢:感谢成都地奥制药集团药物筛选中心在生物活性测试方面所做的工作!
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|