多孔镍通过同时在水溶液中析出氢气及还原镍离子电沉积生成,其在强碱溶液中对乙醇表现出良好的电催化氧化效果。 在1 mol/L KOH溶液中,多孔镍的电极反应为准可逆的 β-氢氧化镍与 β-羟基氧化镍之间质子耦合电子转移。 循环伏安图显示峰值电流密度与电势扫描速度平方根成线性关系,据此计算可得多孔镍的质子扩散系数值为2.92×10-8 cm2/s,其高于块状镍体系的质子扩散系数值约4个数量级,这可能由真实表面积增大导致。 循环伏安法和计时电流法用来表征多孔镍对乙醇的电催化氧化能力,相对于(220)镍电极,多孔镍表现出更高的催化效率,计时电流法测量的催化反应速率常数为7.17×103 cm3/(mol·s)。
Porous nickel was electrodeposited by the reduction of nickel ions with the evolution of hydrogen bubble in aqueous solution. This material shows outstanding performance for electrocatalytic oxidation of ethanol in a strong base solution. Quasi-reversible proton coupled electron transfer reaction between β-Ni(OH)2and β-NiOOH is observed for porous nickel in 1 mol/L KOH solution. From the cyclic voltammograms, a linear relationship between peak current density and square root of potential scan rate is obtained. Based on this relationship, proton diffusion coefficient is calculated to be 2.92×10-8 cm2/s for porous nickel, which is four order of magnitude higher than that for bulk nickel due to the increased real surface area. Cyclic voltammetry and chronoamperometry have been used to characterize the electrocatalytic oxidation ability of porous nickel toward ethanol. In comparison to Ni(220), porous nickel gives a higher catalytic efficiency. The catalytic reaction rate constant is measured to be 7.17×103 cm3/(mol·s) by chronoamperometry.
有机小分子电催化是一个备受研究人员关注的电化学过程,其在燃料电池、有机合成、药物分析及水污染处理等领域均起着核心作用。 随着化石燃料的逐渐耗尽,乙醇因为易生产、可再生及无毒害,同时具有易储存和携带较高的能量密度等优点而广受重视,其中一个重要的研究内容就是乙醇的电催化氧化过程[1]。 相对于常用的贵金属催化剂,金属镍及镍基催化剂因其价格低廉、储量丰富正越来越多地应用在乙醇的电催化氧化过程中。
到目前为止,一些不同形貌和结构的镍及镍基电极已被设计制备用于电催化氧化乙醇。 在铜盘电极上,黄令等[2]电沉积了高择优取向(220)镍电极。 Stradiotto等[3]在弱酸性水溶液中将镍纳米粒子电沉积在硼掺杂金刚石(BDD)电极上。 以多孔氧化铝为模板,孔景临等[4]结合交流电沉积和化学镀制备出镍纳米线电极,田熙科等[5]通过脉冲电沉积成功制备高度有序镍铜合金纳米线。 晋冠平等[6]及王峰等[7]分别通过直接电沉积的方法和联氨还原反应将镍纳米粒子修饰在多壁碳纳米管上。 王春明等[8]制备了非贵金属镍钴石墨烯修饰玻碳电极。 硼掺杂镍基电极材料也逐渐开始引起重视,郑一雄等[9]在低碳钢及纳米孔铜基体上化学沉积非晶态纳米镍硼合金,Muench等[10]通过聚合物模板法合成镍硼纳米管。 Barbosa等[11]研究表明多晶镍在低温至-15 ℃对乙醇仍有良好的电催化氧化能力。
多孔镍材料具有三维网状结构,孔隙率大,比表面积高。 可用作电容器及电池电极,吸声材料,过滤材料及催化剂等。制备多孔镍有诸如脱合金法、模板法、气泡法、溶胶凝胶法、气相沉积法及燃烧合成法等多种手段[12,13,14,15,16,17]。 其中氢气泡模板法因其操作过程简便经济,制得的多孔镍孔径可调等多种优势引起了工业界的极大兴趣,Plowman等[18]指出氢气泡模板法可以单步电沉积出从纳米到微米孔径,形貌各异的金属及合金等材料,蓝闽波等[19]的工作表明,通过这种方法制备的多孔镍对葡萄糖的电催化检测表现出很高的灵敏度。 本文主要工作是通过氢气泡模板法制备多孔镍,探讨其在强碱性溶液中对乙醇的电催化氧化能力。
CHI650E型电化学工作站(上海辰华公司);S-3400N型扫描电子显微镜(SEM,日本日立公司);D8 ADVANCE型X射线衍射仪(XRD,德国布鲁克公司)。 镍片、六水氯化镍、浓硫酸及氢氧化钾购买于上海阿拉丁有限公司,实验用水为超纯水。
镍片(1.0 mm×4.5 mm)经金相砂纸打磨、丙酮及超纯水洗后备用。 氢气模板法制备多孔镍工艺类似蓝闽波等[19]工作,以银/氯化银电极(SCE)为参比电极、铂片为辅助电极,清洗后镍片为工作电极,电沉积液为0.2 mol/L NiCl2·6H2O+1 mol/L H2SO4,恒电流( j=0.27 A/cm2)电沉积10 s后取出并超纯水清洗备用。
电化学测试三电极系统:工作电极为氢气模板法制备多孔镍电极,SCE为参比电极,辅助电极为铂片电极,电解质溶液为1 mol/L KOH。 测试方法为循环伏安法和计时电流法。
如图1 A所示,多孔镍孔径分布从几十纳米至上千纳米,气泡间的距离较大而使得孔之间相距较远,这可能与小的电流密度( j=0.27 A/cm2)及电沉积时间(10 s)有关。 多孔镍结构通过XRD进行表征,由图1 B可知,3个特征衍射峰分别位于44.4°、51.7°及76.6°,分别对应面心立方镍(111)、(200)和(220)晶面(JCPDS File Card No. 04-0805)。
已有研究表明,金属镍在强碱性溶液中发生钝化,外加电势条件下,发生如下反应[20]:
Ni+2OH-→Ni(OH)2+2e-
Ni(OH)2 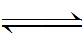
或被认为是:
Ni(OH)2+OH- 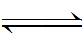
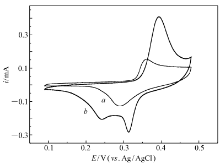
图2曲线 a为多孔镍电极在1 mol/L氢氧化钾水溶液中的初次循环伏安图,明显可以观察到一对氧化还原峰,氧化还原峰位分别位于360和290 mV。 随着扫描的进行,氧化还原峰值电流缓慢增大,峰值电位缓慢正移,同时在电位更负的地方出现新的还原峰。 如图2曲线 b所示,在扫描3 h后,氧化峰位为393 mV,还原峰位分别是314和242 mV。 Bode等[21]阐述了氢氧化镍的氧化还原行为,用所谓bode图表示(Scheme 1)。
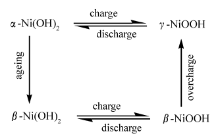 | Scheme 1 Bode diagram showing transformations among various phases of nickel positive electrode[21] |
氢气泡模板法制备的多孔镍在强碱溶液体系中稳定存在的是 γ相还是 β相的羟基氧化镍是一个需要回答的问题。 Marioli等[22]在对块状镍的循环伏安行为的研究中得到了类似的图,认为在块状镍表面同时形成 α相和 β相,并认为 α/γ相之间转换的还原电位要小于 β/β相之间转换的还原电位,这一点与Oliva等[23]观点类似。 综合已有的结论,基于图2可以认为,在碱性溶液中,多孔镍表面首先生成了 β相Ni(OH)2,峰电位360和290 mV分别对应 β-Ni(OH)2与 β-NiOOH之间的氧化还原过程。 扫描3 h后,由峰电流增大可知电极表面镍离子浓度增多,同时 β-Ni(OH)2与 β-NiOOH之间相互转换峰电位分别正移至393及314 mV,峰电位之差随多孔镍表面Ni(OH)2和NiOOH浓度增大由70 mV提高到79 mV。 随着扫描的进行,部分 β-NiOOH缓慢生成 γ-NiOOH,峰电位242 mV表征 γ-NiOOH还原成 α-Ni(OH)2过程,而在碱性溶液中 α-Ni(OH)2能够快速生成 β-Ni(OH)2。 在对乙醇的电催化氧化中,假设 β-Ni(OH)2与 β-NiOOH之间的相互转换占主导。
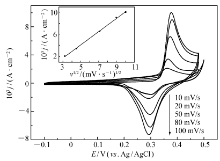
图3为多孔镍在1 mol/L KOH溶液中不同扫描速度下的循环伏安图。 随扫描速度的增大,峰值电位变化不显著,而峰值电流明显增大。 由图3内图可知,峰电流密度 jpc与扫描速率平方根 v1/2成正比,因此对于电极反应:
β-Ni(OH)2 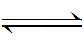
反应速度由扩散而不是电子转移控制。已有研究认为,当扫描速率较大时,质子在镍电极体相的扩散是速率控制步骤,在此可以认为,对于多孔镍电极,电极过程动力学由质子在多孔镍体相中的扩散控制,质子扩散系数就成为了表征镍基电极动力学的重要参数,一般通过循环伏安法进行测定。质子扩散系数可通过下式[24]计算:
式中, ip、 v、 n、 A、 D、 c分别表示峰值电流、扫描速度、转移电子数、电极表观面积、质子扩散系数和质子浓度。
由电极反应方程式可知,质子浓度等于多孔镍在氢氧化钾溶液中生成的氢氧化镍浓度,其等于氢氧化镍的密度除以氢氧化镍的相对分子质量,氢氧化镍的密度[25]可估算为3.97 g/cm3。 结合图3插图所得斜率及式(1)计算可得,多孔镍电极的质子扩散系数为2.92×10-8 cm2/s,比块状镍电极[9]的质子扩散系数4.27×10-12 cm2/s高出4个数量级,也较镍纳米线[4]的质子扩散系数1.4×10-9 cm2/s高出一个数量级,略小于镍硼非晶态合金纳米电极[9]的质子扩散系数2.2×10-7 cm2/s。
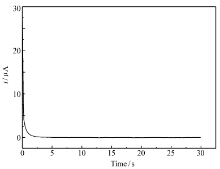 | 图4 多孔镍电极在1 mol/L KOH溶液中电位从-255 mV到阶跃到-175 mV条件下电流时间图Fig.4 Chronoamperomgrams of the porous nickel electrode in 1 mol/L KOH solution under the condition of the potential step from -255 mV to -175 mV |
恒电位方波法是一种简单可行的测量电极真实表面积的方法,图4为多孔镍电极在1 mol/L KOH溶液中电流时间图,电位从-255 mV到阶跃到-175 mV,此电势区间只对双电层充放电。
双电层微分电容 Cd由式(2)结合图4计算而得:
式中,Δ E为阶跃电位,多孔镍电极的真实表面积可通过 Cd与汞电极的双层电容值(20 μF/cm2)比较而得。 通过恒电位方波法计算得到多孔镍电极表面的真实表面积为3.54 cm2,而表观表面积为0.09 cm2,所以可知电极表面积增大了39.3倍。 之所以多孔镍电极具有较大的质子扩散系数,一个可能的解释是电极具有很高的真实表面积,这会导致电极与电解液的接触程度增大,缩短质子在Ni(OH)2固相中的扩散距离,继而提高了扩散系数。
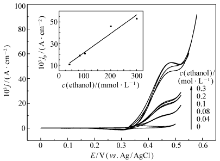
图5为多孔镍电极在不同乙醇浓度时的1 mol/L KOH溶液中10 mV/s扫描速度循环伏安图。 图中可以明显看出,加入乙醇后,氧化峰电流密度明显增大,这说明多孔镍在强碱性溶液中对乙醇起到了电催化氧化的作用。 当电势扫描至0.5 V时,析氧过程开始出现。 随着乙醇浓度的升高,氧化峰电流密度逐渐增大,图5内图表明乙醇浓度与催化峰电流密度成正比,这表明在0~0.3 mol/L的乙醇浓度范围内,乙醇的扩散步骤控制了电催化过程动力学。 在0.1 mol/L乙醇浓度及10 mV/s扫描速度条件下,多孔镍电极的催化电流密度为2.1×10-2 A/cm2,是高择优取向(220)镍电极[2]催化电流密度3.5×10-3 A/cm2的6倍。 需要指出的是,多孔镍电极的催化电流密度低于Ni-B非晶态合金纳米微电极[9]的3.38×10-1 A/cm2,这其中的原因值得进一步探讨。
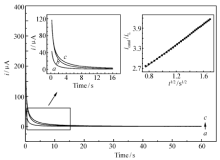
计时电流法可以用来定量描述多孔镍对乙醇的电催化氧化能力。图6为多孔镍在含有不同浓度乙醇的1 mol/L KOH的电位从455 mV到阶跃到-225 mV条件下电流时间图,可以发现,随着乙醇浓度的增加,电化学响应电流也随之增大。 通过计时电流法来计算多孔镍对乙醇的电催化氧化反应速率常数的过程[26]简述如下。
对于电催化体系有:
式中, icatal与 iL分别为多孔镍电极在1 mol/L KOH溶液中加乙醇和不加乙醇溶液的电流, λ=kct是误差方程,其中 k是催化反应速率常数, c是乙醇的浓度, t为反应时间。如果 λ>1.5; erf( λ0.5)→1; erf( -λ) /λ0 .5。式(3)可简化为:
通过电流时间关系曲线可以导出 icatal/ iL与 t1/2的斜率,如图6内图(右)所示, icatal/ iL对 t1/2表现出良好的线性关系,满足式(4),计算可以得到,在1 mol/L KOH溶液中,多孔镍电极对0.1 mol/L乙醇的催化反应速率常数等于7.17×103 cm3/(mol·s),比Ni-B非晶态合金纳米微电极[9]对0.15 mol/L乙醇的催化反应速率常数1.03×105 cm3/(mol·s)低约一个数量级。
氢气泡模板法制备多孔镍过程条件简单易控,一般认为,在1 mol/L KOH溶液中,多孔镍的电极过程为准可逆过程且主要在 β-Ni(OH)2/ β-NiOOH之间转化。 制备的多孔镍具备较大的质子扩散系数及粗糙度,循环伏安法测定的多孔镍的质子扩散系数高于块状镍的报道值约4个数量级。 多孔镍对碱性溶液中的乙醇具有良好的电催化氧化作用,循环伏安图表明,多孔镍电极的催化电流密度为是高择优取向(220)镍电极[2]催化电流密度的6倍,计时电流法测量得到多孔镍电催化氧化乙醇反应速率常数等于7.17×103 cm3/(mol·s),多孔镍对乙醇良好的电催化氧化性能可归结于其较大的真实表面积。 可以预计的是,氢气泡模板法制备多孔镍及镍基合金将会是一类良好的用于氧化醇类化合物的电催化剂。
致谢:特别感谢江西师范大学化学化工学院殷顺高博士在SEM和XRD测量时提供的协助。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|