基于适配子构建了无标记检测三磷酸腺苷(ATP)的微悬臂梁生物传感器。 将ATP适配子修饰在微悬臂梁阵列中的传感悬臂镀金面上,用来识别ATP,而参比悬臂修饰巯基己醇(MCH)防止非特异性吸附。 ATP与其适配子发生特异性相互作用,使悬臂的上下两个表面产生应力差,导致传感悬臂产生偏转,扣除参比悬臂偏转后其偏转值与ATP的浓度在0.5~5 mmol/L范围内有良好的线性关系,相关系数为0.998,最低检出限为0.06 mmol/L。 该微悬臂梁生物传感器响应快速、操作简单,并且对ATP具有良好的特异性。
Reveived 2014-12-22; Revised 2015-01-15; Accepted 2015-01-16
An aptamer-based microcantilever biosensor for label-free detection of adenosine triphosphate(ATP) was developed. The sensor cantilevers in the microcantilever array were functionalized with ATP aptamer on the gold side to recognize ATP, while the reference cantilevers were modified by 6-mercapto-1-hexanol(MCH) to prevent non-specific absorption. The interaction between ATP and aptamer on the sensor cantilerers gold surface induced surface stress changes, resulting in a differential deflection between the sensor and reference cantilevers. The differential deflection has a good linear relationship with the ATP concentration ranging from 0.5~5 mmol/L with a correlation coefficient of 0.998. The detection limit is about 0.06 mmol/L. The aptamer-based microcantilever sensor shows rapid response, simple procedures and high specificity for ATP.
微悬臂梁生物传感器是一种新兴的传感器技术, 它将发生在微悬臂梁表面的生物化学反应转化为纳米机械运动或者是将表面反应引起的质量变化转变为频率变化以实现检测目的。 微悬臂梁生物传感器在生物分子检测中具有响应快、灵敏度高、无需标记和实时监测等特点, 已经受到广泛的关注, 已用于DNA杂交检测[1]、硫醇自组装过程[2]、细胞吸附[3]和蛋白质检测等[4, 5]方面的研究。
适配子(aptamer)是指从随机寡核苷酸文库中通过指数富集的配体系统进化技术筛选得到单链DNA或RNA[6, 7], 能与各种靶分子高特异性、高亲和力地结合, 例如小分子、蛋白质、病毒甚至细胞[8, 9]。 与抗体相比较, 适配子具有合成简单、易于标记、稳定性好并且可以长期保存等优点, 因此, 适配子已被广泛地用作生物传感器的识别元件, 比如表面等离子共振技术[10]、荧光传感器[11]、石英晶体微天平[12]和电化学传感器等[13]。
三磷酸腺苷(adenosine triphosphate, ATP)是生物体内一切生命活动所需能量的直接来源, 参与机体各种生化反应过程, 被誉为细胞内能量的“ 分子货币” 。 已有研究发现生物体内ATP的浓度和消耗率与许多疾病密切相关, 如缺氧、低血糖、局部缺血、帕金森病和一些恶性肿瘤。 另外, 生物体内ATP含量的变化也可以作为评估各种小分子药物和生物制剂引起的细胞杀伤、细胞抑制和细胞增殖作用。 因此, 准确、快速的检测ATP在生化研究和临床诊断中非常重要[14]。 目前已有许多基于适配子的生物传感器来检测ATP,
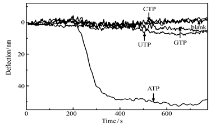
例如电化学发光和荧光共振能量转移等[15, 16]。 然而这些方法通常需要标记, 而且标记过程费时, 标记物昂贵。 在本文中, 我们将ATP适配子作为识别分子, 经由Au— S 键固定于悬臂金表面。 由于ATP与适配子特异性相互作用, 使悬臂的表面应力发生变化, 导致悬臂产生偏转。 检测原理如图1所示, 传感悬臂(2, 4, 6, 8)修饰ATP适配子, 参比悬臂(1, 3, 5, 7)修饰巯基己醇(MCH)防止非特异性吸附, 二者偏转的差值显示了ATP与适配子的特异性相互作用。
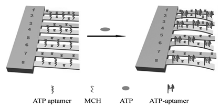 | 图1 功能化的微悬臂梁阵列对ATP的检测过程示意图Fig.1 Schematic representation of the functionalized microcantilever array for ATP detection |
微悬臂梁购自Concentris GmbH公司(Switzerland), 三磷酸腺苷(adenosine triphosphate, ATP), 三磷酸胞苷(cytidine triphosphate, CTP), 三磷酸鸟苷(guanosine triphosphate, GTP), 三磷酸尿苷(uridine triphosphate, UTP)均购自阿拉丁试剂(上海)有限公司; 末端修饰巯基的ATP适配子(5'-HS-(CH2)6-TTTTTTCCTGGGGGAGTATTGCGGAGGAAGGT-3')由上海生物工程公司合成; 三(2-羧乙基)膦盐酸(TCEP)盐购自Alfa Aesar; 6-巯基1-己醇(MCH)购自Sigma-Aldrich; NaCl、MgCl2、HCl、H2SO4(98%)和H2O2(30%)均为分析纯, 购自北京化学品公司。 流动缓冲溶液为20 mmol/L Tris-HCl, 300 mmol/L NaCl, 5 mmol/L MgCl2, pH=7.6; ATP适配子缓冲溶液为:20 mmol/L Tris-HCl, 300 mmol/L NaCl, 5 mmol/L MgCl2, 1 mmol/L TCEP, pH=7.4。 实验过程中所用水均为超纯水(18.2 MΩ · cm), 由Milli-Q系统(Millipore)制备。
实验中所使用的微悬臂梁阵列由8支悬臂组成, 悬臂长500 μ m, 宽100 μ m, 厚1 μ m。 单面镀有20 nm厚的金, 该镀层用于表面修饰和增强反射。 微悬臂梁阵列在每次使用前分别用无水乙醇和Milli-Q水清洗, 然后用piranha溶液(体积比为3∶ 7的30%的H2O2和98%的H2SO4)清洗, 再用大量Milli-Q水冲洗3次, 然后将其放在臭氧环境中用紫外照射30 min, 最后再分别用无水乙醇和Milli-Q水冲洗。 微悬臂梁阵列清洗干净后, 将其中4支悬臂插入装有ATP适配子溶液(1 μ mol/L, 末端修饰巯基)的毛细管中, 在室温下反应3 h。 ATP适配子通过金硫键的作用自组装到悬臂的金表面。 然后将修饰ATP适配子的微悬臂梁阵列浸入2 mmol/L MCH溶液中1 h, 一方面巯基己醇占据传感悬臂金表面未修饰适配子的空余位点, 以防止非特异性吸附; 另一方面在未修饰适配子的其它4支悬臂的金表面上形成MCH自组装单层膜, 这4支悬臂作为参比悬臂。 最后, 用无水乙醇和Milli-Q水将微悬臂梁阵列冲洗干净备用。
实验中所使用的检测仪器为Concentris GmbH公司(瑞士)生产的商业化传感器平台, 其配备有一个容积为5 μ L的反应池、自动化液体处理系统和一个集成的温度控制与样品预热装置。 在实验过程中温度一直控制在(25± 0.01) ℃。 功能化的微悬臂梁阵列被放置在反应池中, 在反应池中缓冲溶液以0.42 μ L/s速度通过微悬臂梁阵列, 直到获得一个稳定的基线。 然后再通入ATP溶液, 大约10 min ATP溶液全部流过反应池, 缓冲溶液被再次泵入。 利用微悬臂梁生物传感装置进行实时监测ATP与其适配子的特异性相互作用。
将功能化的微悬臂梁阵列固定到反应池中, 流动缓冲溶液以0.42 μ L/s速度通过反应池, 直到获得一个稳定的基线。 然后加入2 mmol/L ATP, 当在大约200 s时, ATP到达反应池中, 与适配子在悬臂的一侧表面发生特异性作用, 从而在这个表面产生一个表面应力的改变, 这种单侧表面应力的改变在悬臂的上下表面产生一个应力差, 驱使悬臂发生偏转。 图2A所示, 当2 mmol/L ATP溶液通过反应池时, 修饰ATP适配子的悬臂发生明显的偏转, 而修饰MCH的悬臂发生一个相对较小的偏转。 参比悬臂的偏转反映了溶液的环境变化(如热漂移、机械噪音等)以及非特异性吸附。 图2B为从传感悬臂的偏转值中扣除参比悬臂的偏转值所得, 即由ATP与适配子发生特异性相互作用导致的悬臂偏转。 悬臂的偏转可能是由于当ATP与适配子结合后, 由于构象变化导致相邻的链之间形成逐渐增长的斥力, 从而引起悬臂的弯曲。
图3A为由传感悬臂的偏转值中扣除参比悬臂的偏转值得到, 为不同浓度的ATP和适配子相互作用诱导的微悬臂梁阵列偏转的实时曲线。 从结果中可以看出, 不同浓度的ATP引起不同的悬臂偏转值, 悬臂的偏转值随着ATP的浓度增加而增大。 图3B为不同的悬臂偏转值与不同浓度的ATP的线性关系图, ATP的浓度分别为0.5、1、2、3、4、5和10 mmol/L。 图3B中插图表明悬臂的偏转值与ATP浓度在0.5~5 mmol/L之间具有良好的线性关系, 其相关系数为0.998。 悬臂的偏转值与ATP浓度之间的线性方程为Y=-1.36+23.31X, 式中, Y为悬臂的偏转值(nm), X为ATP的浓度(mmol/L)。 该微悬臂梁生物传感器对ATP的检出限为0.06 mmol/L(S/N=3)。
为了检验ATP微悬臂梁生物传感器对ATP识别的特异性, 在相同的实验条件下通入ATP类似物如:CTP、GTP和UTP, 浓度均为2 mmol/L。 如图4所示, 通入的CTP、GTP和UTP均不能引起悬臂产生明显的偏转, 而相同浓度的ATP则使悬臂发生明显的偏转。 实验结果表明, 该微悬臂梁生物传感器对ATP具有高度的特异性。
通过将巯基化的适配子由Au— S键将其修饰在悬臂金表面, 成功地建立了一种利用微悬臂梁生物传感器检测ATP的简单方法。 实验结果表明, 建立的微悬臂梁生物传感器对ATP具有良好的选择性, 并且在0.5~5 mmol/L的浓度范围内具有良好的线性关系, 相关系数为0.998, 最低检出限为0.06 mmol/L。 与传统的检测方法相比, 微悬臂梁生物传感器检测技术是一种无需标记的检测手段, 并可实时监测ATP与适配子特异性相互作用的动态过程和实验信息。 因此, 微悬臂梁生物传感器作为一种新型平台, 在生物分子间相互作用力的研究及其检测过程中起到重要作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|