以氯甲酸异丙酯、水合肼为主要原料,制备肼-1,2-二甲酸二异丙酯,然后用双氧水氧化制得偶氮二甲酸二异丙酯(DIAD)。 研究确定了最佳的反应条件:在0 ℃以下乙醚溶剂中,水合肼和氯甲酸异丙酯反应2 h,制备肼-1,2-二甲酸二异丙酯; n(肼-1,2-二甲酸二异丙酯)∶ n(双氧水)=1∶1.1,在-5~5 ℃下反应2 h,双氧水氧化得到偶氮二甲酸二异丙酯,总收率为90.7%,采用红外光谱、核磁共振等技术手段验证了中间体及目标产物结构。
Reveived 2014-03-31; Revised 2014-08-15; Accepted 2014-10-10
Isopropyl chloroformate and hydrazine were used as starting materials to prepare diisopropyl hydrazine-1,2-dicarboxylate, and then diisopropyl azodicarboxylate(DIAD) was prepared by oxidization with hydrogen peroxide. Factors influencing the reaction were investigated. Diisopropyl hydrazine-1,2-dicarboxylate was prepared by the reaction of hydrazine and chloroformate below 0 ℃ for 2 h in ether; under optimal reaction condition of n(diisopropyl hydrazine-1,2-dicarboxylate)∶ n(hydrogen peroxide) with 1∶1.1 at -5~5 ℃ for 2 h, the total yield of DIAD reached 90.7%. The structures of intermediate and product were characterized by IR and1H NMR.
偶氮二甲酸二异丙酯(DIAD)是一种重要的有机合成中间体, 可作为环化试剂进行Mitsunobu反应。 Mistunobu反应是在偶氮二碳酸二乙酯(DEAD)或DIAD和三苯基膦作用下, 醇类化合物和含活泼氢的酸性化合物发生取代反应, 形成C— O、C— S、C— N和C— C等键的反应。 该反应是Mitsunobu等于1967年发现的, 一般在温和的中性条件下进行, 因此, 该反应被广泛用于天然产物的全合成, 或者化合物的官能团转换, 应用范围较为广泛[1]。 DIAD也可用于光敏剂、聚合催化剂、杀菌剂等产品的合成; 还可与烯基树脂的液体发泡剂反应[2], 用于制备浅色乙烯基泡沫塑料, DIAD与塑胶混溶性好, 分解产物无色、无毒、无污染、无臭味, 在40~120 ℃范围内可获得高发气量, 应用前景广阔。
现有的偶氮二羧酸二烃基酯是先由氯代羧酸酯和水合肼或者肼基酯发生缩合反应制备肼二羧酸二烃基酯, 肼二羧酸二烃基酯经浓硝酸、氯气、溴素、N-溴代丁二酰亚胺(NBS)等氧化剂氧化得到偶氮二羧酸二羟基酯。
肼二甲酸二乙酯的常用合成是以氯甲酸乙酯、水合肼为原料, 15~20 ℃下反应0.5 h制得肼二甲酸二乙酯[3]; Matveeva等[4]用该方法制得肼二甲酸二乙酯, 收率56%, 再以苯和水为溶剂, 采用氯气氧化肼二甲酸二乙酯制得偶氮二甲酸二乙酯, 收率81%。 该方法用到氯气和有机溶剂苯, 氯气易挥发, 苯毒性大, 对设备要求较高。
NBS试剂氧化反应, 多采用吡啶做缚酸剂, Hideyuki等[5]制备偶氮二甲酸甲基叔丁基酯时, 先以氯甲酸甲酯和肼甲酸叔丁酯为原料, 在-78 ℃下反应24 h, 得到肼二甲酸甲基叔丁基酯, 再与吡啶、NBS试剂反应得到偶氮二甲酸甲基叔丁基酯, 总收率75.6%。 Kazutake等[6]在常温下以二甲苯为溶剂、吡啶、NBS试剂和肼二甲酸二-(2-甲氧基乙基)酯反应3 h制得偶氮二甲酸二-(2-甲氧基乙基)酯, 收率为85%。 该反应中吡啶气味很重, 并且溴素容易游离出来, 对环境造成污染。
采用HNO3氧化合成偶氮二羧酸二烃基酯典型反应是偶氮二甲酸二-(2, 2, 2-三氯乙基)酯和偶氮二甲酸二丙酯的合成, Daniel等[7]以肼二甲酸二-(2, 2, 2-三氯乙基)酯为原料, 采用HNO3氧化得到偶氮二甲酸二-(2, 2, 2-三氯乙基)酯, 收率为76%, 反应过程中有大量氮氧化物生成; 廉鹏[8]等用HNO3氧化肼二甲酸二丙酯得到偶氮二甲酸二丙酯, 收率达到99.8%。 采用HNO3氧化, 反应收率比较高, 但是能耗大、对设备要求高、容易产生大量氮氧化合物污染环境。
综上所述, DIAD合成方法是通常是氯甲酸异丙酯和水合肼反应合成肼-1, 2-二甲酸二异丙酯, 再用浓硝酸、氯气、溴素、NBS等氧化剂氧化而得[9, 10]。 浓硝酸为氧化剂, 在0 ℃以下氧化, 产生大量的氮氧化物, 氮能引起水环境的富营养化, 环境污染严重。 文献[11]直接用氧化剂NBS在吡啶环境中氧化肼酯得到产品DIAD, 产率高达90%以上, 但由于溴素在水中溶解度不大, 容易挥发造成大气污染, 安全性差, 且成本较高。代表反应路线见图1。
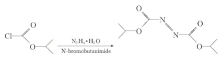 | 图1 NBS氧化法合成DIADFig.1 Synthesis of DIAD by NBS oxidationSteps/Stages:1.1 R:Disodium carbonate, R:N2H4· H2O, S:THF, cooled; 1 h, cooled 1.2 R:C5H5N, R:Bromosuccinimide, S:PhMe, 2 h, 20 ℃ |
采用氯气在碱性条件下氧化肼-1, 2-二甲酸二异丙酯, 用有机溶剂萃取后, 再脱除溶剂得产品[9], 该方法产生大量次氯酸钠, 三废排放高, 对环境污染严重, 不经济环保。 以苯系物为溶剂, 吡啶、NBS试剂氧化法在常温下制备偶氮二甲酸二烃基酯, 反应条件温和, 收率高[10], 溴素在水中溶解度不大, 容易挥发造成大气污染, 且成本较高。
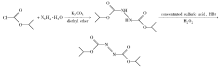
本文以氯甲酸异丙酯和水合肼为原料, 制备肼-1, 2-二甲酸二异丙酯; 双氧水为氧化剂, 氢溴酸为催化剂, 在低温浓硫酸酸性条件下氧化肼-1, 2-二甲酸二异丙酯制得DIAD。 该反应合成方法简便, 副反应少, 氢溴酸为催化剂量, 不会产生大量溴。 反应中浓硫酸可以很好的溶解肼-1, 2-二甲酸二异丙酯, 可以循环使用, 经济性好, 具有良好的应用前景[12]。 反应路线如图2所示。
氯甲酸异丙酯、水合肼(80%)、无水碳酸钾、乙醚、浓硫酸(98%)、氢溴酸(40%)、双氧水(30%)、二氯甲烷等均为分析纯试剂。
WRS-2型微机熔点测定仪(上海申光仪器仪表有限公司), FT-IR 200 XB型红外光谱仪(美国Nicolet公司), Bruker Avance Ⅲ 500MHz核磁共振仪(CDCl3, TMS为内标, 瑞士Bruker公司), LC-20AT型C18柱液相色谱仪(日本岛津公司)。
1.2.1 肼-1, 2-二甲酸二异丙酯的制备 在装有搅拌器、温度计、滴液漏斗的250 mL三颈瓶中, 依次加入49.02 g(0.4 mol)氯甲酸异丙酯, 乙醚(80 mL), 干燥的粉末碳酸钾41.5 g(0.3 mol), 搅拌, 冰盐浴降温至0 ℃以下, 缓慢滴加水合肼12.5 g(0.2 mol), 温度控制在0 ℃以下; 滴加完毕后继续反应2 h, 反应结束, 瓶中有大量白色固体析出。 向反应瓶中混合物倾入冰水(100 mL), 减压抽滤, 用50 mL水洗涤固体3次, 烘干, 得到白色晶状固体肼-1, 2-二甲酸二异丙酯39.4 g, 收率为96.6%, 经HPLC测定其色谱含量为95.08%, HPLC测定条件为:C18柱分离, 柱温25 ℃, 甲醇-水(体积比8∶ 2)为流动相, 流速1.0 mL/min, 紫外检测波长230 nm。 mp 106.1~107.6 ℃(文献值[13]:105~107 ℃), 1H NMR(CDCl3, 500 MHz), δ :1.26~1.27(d, 12H, CH3); 4.95~5.00(m, 2H, CH); 7.27(s, 2H, NH)。
1.2.2 偶氮二甲酸二异丙酯的合成 在装有搅拌器、温度计、滴液漏斗的250 mL三颈瓶中, 依次加入10.2 g(0.05 mol)肼-1, 2-二甲酸二异丙酯, 水(50 mL), 搅拌下加入浓硫酸(50 mL)至固体全溶; 加入40%的氢溴酸0.2 g(0.001 mol), 控制在0 ℃以下滴30%双氧水6.23 g(0.055 mol), 1 h滴加完毕, 溶液为橘红色, 0 ℃下反应2 h。 反应完毕后静置, CH2Cl2萃取, 萃取液反复水洗至中性, 水洗液回收, 用无水MgSO4干燥, 蒸馏回收溶剂, 在75~80 ℃(2 mm Hg)下减压蒸馏得到淡黄色液体偶氮二甲酸二异丙酯9.48 g, 收率93.9%, 经HPLC测定其色谱含量为97.53%, HPLC测定条件为:C18柱分离, 柱温25 ℃, 甲醇-水(体积比8∶ 2)为流动相, 流速1.0 mL/min, 紫外检测波长285 nm; 1H NMR(CDCl3, 500 MHz), δ :1.42~1.44(d, 12H, CH3); 5.20~5.28(m, 2H, CH); IR(Liquid film), σ /cm-1:2987.0(C— H), 2940.6(C— H), 1776.2( 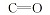
2.1.1 有机溶剂对缩合反应的影响 氯甲酸异丙酯和水合肼反应属于缩合反应, 是有机合成中的一类常见反应, 反应条件温和, 本反应采用K2CO3为缚酸剂, K2CO3比较容易过滤, 不易结块, 并且价格廉价, 容易回收。 反应产物的摩尔配比为n(氯甲酸异丙酯)∶ n(水合肼)∶ n(碳酸钾)=2∶ 1∶ 1.5。 一般在有机溶剂中加入缚酸剂, 除去缩合过程中产生的氯化氢, 然后过滤除去盐酸盐, 母液浓缩得到缩合物。 本文采用稳定性好的乙醚作为溶剂, 并用廉价的K2CO3为缚酸剂, 在0 ℃以下低温反应, 水解反应的影响可以忽略。 实验结果见表1。
| 表1 有机溶剂对缩合反应的影响 Table 1 Effect of solvent on the condensation reaction |
从表1可以看出, 在非亲水性有机相二氯甲烷和乙醚中, 反应收率比较高, 反应溶剂可以回收循环使用。 而在亲水性有机相甲醇和丙酮中, 收率比较低。
2.1.2 缩合反应时间对反应的影响 由2.1.1节得知, 选用稳定性好, 收率高的乙醚作溶剂, 原料配比不变, 考察反应时间对产率的影响, 见表2。
| 表2 不同的反应时间对反应的影响 Table 2 Effect of reaction time on the reaction |
由表2可以看出, 反应0.5 h, 收率就达到81.8%, 在非亲水性溶剂乙醚中, 缩合反应条件温和, 比较容易进行; 反应1 h, 产率高达92.7%, 之后反应速度缓慢, 在2 h左右, 产率达到最高值, 随着反应时间增长, 反应收率没有明显变化, 该低温反应体系中, 产物稳定。
2.2.1 氧化剂对反应的影响 该反应选用了温和的氧化剂双氧水, 理论上氧化1 mol肼-1, 2-二甲酸二异丙酯需要1 mol的双氧水, 实验中考虑到双氧水反应过程中的分解, 则需要加入稍过量的双氧水。 实验发现, 滴加双氧水浓度过大或滴速过快, 会造成温度快速升高。 双氧水的浓度不能过大, 本实验采用30%市售双氧水; 滴加过程要缓慢, 否则, 会造成氧化反应局部温度过高, 产物分解, 导致收率降低。
2.2.2 催化剂用量对反应的影响 本文使用40%氢溴酸为催化剂, 在保持肼-1, 2-二甲酸二异丙酯、双氧水摩尔比和其它条件不变的情况下, 考察了不同催化剂的用量对反应的影响, 实验结果见表3。
| 表3 不同的催化剂用量对反应的影响 Table 3 Effect of different catalyst on the reaction |
实验发现, 氢溴酸的浓度过大, 会导致局部氧化温度过高, 使产物分解, 收率降低; 氢溴酸浓度低时, 反应速度慢, 原料反应不完全。实验结果表明, 在该反应条件下, 肼-1, 2-二甲酸二异丙酯、双氧水和催化剂的摩尔比为1∶ 1.1∶ 0.02最为适宜。 具体反应条件为:肼-1, 2-二甲酸二异丙酯0.05 mol, 双氧水0.0055 mol, 催化剂溴化氢0.0010 mol, 反应温度-5~0 ℃, 反应时间2 h, 收率93.9%。
2.2.3 氧化反应温度对反应的影响 DIAD是一种热不稳定化合物, 温度过高容易分解, 尤其是在双氧水滴加过程中, 双氧水与氢溴酸的反应是剧烈放热的, 滴加速度过快容易导致局部温度过高, 造成产物分解, 从而使产率降低, 产品的纯度也降低; 而温度过低, 反应速度则较慢, 同时能耗较大, 成本也较高。 在保持肼-1, 2-二甲酸二异丙酯、双氧水和催化剂用用量以及反应时间不变的情况下, 考察了不同反应温度对反应的影响, 见表4。
| 表4 氧化反应温度对反应的影响 Table 4 Effect of temperature on the oxidation reaction |
由表4可以看出, 反应温度控制在0 ℃左右, 反应效果最好。 控制适宜的滴加速度, 防止局部过热, 可以得到纯度高、收率高的DIAD。
2.2.4 氧化反应时间对反应的影响 在保持肼-1, 2-二甲酸二异丙酯、双氧水和催化剂用用量以及反应温度不变的情况下, 肼-1, 2-二甲酸二异丙酯被双氧水氧化时, 考察了不同反应时间对反应的影响, 见表5。
| 表5 氧化反应时间对反应的影响 Table 5 Effect of reaction time on oxidation reaction |
实验发现, 氧化时间少于2 h, 反应不完全, 目标产物收率较低; 反应进行2 h, 反应物基本完全反应, 目标产物产率较高; 氧化反应时间过长, 会使目标产物分解, 收率降低, 通过TLC检测发现, 有副产物生成。
氯甲酸异丙酯与水合肼在-5~0 ℃制得肼-1, 2-二甲酸二异丙酯, 然后在-5~5 ℃, 用双氧水将其氧化, 制备偶氮二甲酸二异丙酯。 相对于以前所报道的方法的优点为:反应原料易得, 反应操作简单, 改进了使用氯气、浓硝酸氧化的方法, 降低了三废排放, 萃取溶剂可循环使用, 两步法合成DIAD的收率可达90.7%, 具有工业化生产潜力, 其IR、1H NMR等表征结果和文献相符。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|