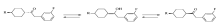含氟丁烯类液晶是一类新型具有低熔点和较高清亮点的液晶材料。 本文提出了一条新的方法合成关键中间体,采用以3-氟苄氯为起始原料,经Arbuzov、Wittig-Horner、催化氢化、锂化-硼酸化4步反应制备,避免了环己烷的异构化和脱氟副反应。 经过合成优化,总收率由4.5%提高到30%,具备较高的应用价值。 物理性能测试表明,该类化合物在配方中的虚拟清亮点达到127.7 ℃、展区常数 K11值高达19.7。 光电测试表明,该类化合物能够缩短10%的液晶总响应时间,与该类化合物粘弹系数小的特点相吻合。 新型含氟丁烯液晶为开发高性能混合液晶提供了新的单体液晶材料。
Reveived 2014-06-11; Revised 2014-09-24; Accepted 2014-10-30
3-Butenyl-based liquid crystals are a new series of liquid crystals with low melting point and high clearing point. A new synthetic method for key intermediate aryl boric acid was improved via Arbuzov, Wittig-Horner, catalytic hydrogenation and lithiation-boric acid 4-step reactions by using 3-fluorobenzyl chloride as the starting material. Isomerization of trans-cyclohexane and defluorination side reactions were avoided. After optimization the total yield was improved from 4.5% to 30%, which is valuable for industrial production. Physical properties test indicates that the new compounds have virtual clearing point of 127.7 ℃ and a large splay elastic constant K11 value of 19.7. Transmittance-voltage test shows that the compound can shorten the total response time by 10%, which coincides with its low elastic-viscosity value. The new 3-butenyl-based liquid crystals have potential applications in developing high performance liquid crystal mixtures.
新型含氟丁烯类液晶1a~1c首次由我国陕西师范大学Jiang等[1]报道, 并对液晶相变规律作了详细研究。 随后含有侧向多氟取代、具有负介电各向异性的液晶材料也被合成出来[2, 3]。 与饱和烷基相比, 引入具有π 电子的丁烯基后, 分子间诱导偶极作用力加强, 带来液晶相区加宽、并且还保持较低的熔点和熔融焓的优点, 有利于拓展液晶工作温度范围。 尽管这类新的液晶材料有可能对液晶显示器件性能带来积极的影响, 但是还存在合成收率低的问题, 围绕显示应用的其他物理性能参数还未见报道。 为进一步推动该类新液晶材料在显示器件中的实际应用, 我们对其中液晶化合物1a~1c的合成进行了改进, 大幅度提高了反应总收率; 并将其溶于母体液晶中对物理及光电性能进行了测试, 探讨了该类液晶化合物对混合液晶性能参数的影响规律, 为其在混合液晶配方中应用提供了基础数据。
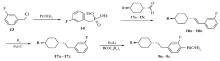
如Scheme 1所示, 文献[1]中化合物1a~1c的合成经历了9步反应, 总收率仅为4.5%左右。对实验数据分析发现, 中间体9a~9c是合成该类化合物的关键, 该步仅20%的收率是造成总收率低的主要原因。即使以纯反式构型的烷基环己烷甲酸为原料, 反应过程中也会出现环己烷的构型翻转, 出现约10%~20%的不需要的顺式异构体; 在酮7a~7c经黄鸣龙还原反应制备8a~8c的过程中, 在强碱性和高温条件下, 出现~10%的脱氟副产物, 使得产物8a~8c的有效含量降低。这些异构体和副产物的存在, 导致硼酸化反应收率降低, 最终产物分离提纯的难度加大。
 | Scheme 1 Synthesis of 3-butenyl-based fluorinated liquid crystals in lit.[1] |
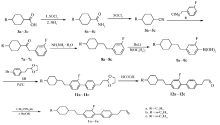
针对以上存在的问题, 我们对关键中间体9a~9c的合成方法进行了改进, 提出了一条新的合成方法, 避免了环己烷的顺反异构化且无脱氟副产物的产生。 并对Suzuki偶联等步骤进行了工艺优化, 最终产物总收率大幅提高, 达到30%左右; 产物的色谱纯度也提高到99.8%~99.9%, 具备实际应用价值。 中间体9a~9c反应合成路线如Scheme 2所示。
反式-4-乙基环己烷甲醛、反式-4-正丙基环己烷甲醛、反式-4-正戊基环己烷甲醛购自西安彩晶光电科技股份有限公司, 其它均为化学纯试剂。 AV500型核磁共振仪(瑞士Bruker公司), 溶剂为CDCl3, TMS为内标; GC-14C型气相色谱仪(日本岛津色谱仪器有限公司), DB-1毛细管柱, 氢火焰检测器; DSQ型气相色谱质谱联用仪(美国热电公司); WRX-1S型显微热分析仪(上海精密仪器有限公司); IV-cust型液晶参数测试仪(美国Instec公司); NAR-4T型阿贝折光仪(日本ATAGO公司)。 10 μ m反平行液晶测试盒、5 μ m 90度扭曲TN液晶测试盒购自广东信利半导体有限公司。
以R=n-C3H7的化合物1b为例, 典型制备方法如下:
1.2.1 (3-氟苄基)膦酸二乙酯(14)的制备 向1000 mL三口瓶中加入498 g(3 mol)亚磷酸三乙酯及290 g(2 mol)间氟氯苄, 搅拌加热至157 ℃, 回流反应7 h。 然后蒸去过量的亚磷酸三乙酯, 得无色透明液体472 g, 收率95.9%, 气相色谱分析产物含量为99.7%。 1H NMR(CDCl3, 500 MHz), δ :1.26(t, 6H, J=7 Hz), 3.14(d, 2H, J=11 Hz), 4.00~4.07(m, 4H), 6.95(t, 1H, J=8 Hz), 7.03(dd, 1H, J=5 Hz), 7.08(d, 1H, J=4 Hz), 7.27(q, 1H); MS m/z(RI, %):246(M+, 19), 190(26), 136(27), 109(100)。
1.2.2 1-氟-3-[2-(反式-4-正丙基环己基)乙烯基]苯(16b)的制备 N2气保护下, 向1000 mL的三口烧瓶中加入185.6 g(0.8 mol)(3-氟苄基)膦酸二乙酯及200 mL四氢呋喃, 搅拌下分批加入134.4 g(1.2 mol)叔丁醇钾, 加完后于室温反应1 h。 滴加61.6 g(0.4mol)反式-4-正丙基环己基甲醛及100 mL四氢呋喃的混合溶液, 滴加完后室温下反应2 h。 反应完毕后, 向体系中加入200 mL冰水及200 mL石油醚, 搅拌水解20 min 。分层, 水层用200 mL石油醚萃取一次, 合并有机相, 水洗至中性, 减压蒸去溶剂, 得无色透明液体88.3 g, 收率89.7%。 产物为E式与Z式混合物, 直接用于下步反应。 MS m/z(RI, %):246(M+, 77), 146(39), 122(100), 109(42), 81(53)。 1H NMR(CDCl3, 500 MHz), δ :0.89(t, J=7.3 Hz, 3H), 0.91~1.26(m, 7H), 1.27~1.37(m, 2H), 1.75~1.85(m, 4H), 2.01~2.11(m, 1H), 5.49(dd, J=8 Hz, J=3.5 Hz, 
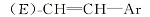
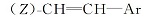
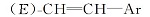
同样方法制备出R为乙基的化合物16a, 收率91.5%, MS m/z(RI, %):232(M+, 82), 146(33), 122(100), 109(35), 81(61); 1H NMR(CDCl3, 500 MHz), δ :0.89(t, J= 7.3 Hz, 3H), 0.91~1.26(m, 5H), 1.27~1.37(m, 2H), 1.75~1.85(m, 4H), 2.01~2.11(m, 1H), 5.49(dd, J=8 Hz, J=3.5 Hz, 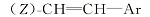

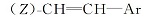
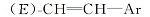
R为正戊基的化合物16c, 收率88.4%, MS m/z(RI, %):274(M+, 65), 146(28), 122(100), 109(44), 81(46); 1H NMR(CDCl3, 500 MHz), δ :0.89(t, J=7.3 Hz, 3H), 0.91~1.39(m, 13H), 1.75~1.85(m, 4H), 2.01~2.11(m, 1H), 5.49(dd, J=8 Hz, J=3.5 Hz, 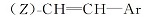
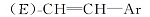
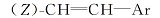
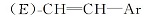
1.2.3 1-氟-3-[2-(反式-4-正丙基环己基)乙基]苯(17b)的制备 上步骤所得的1-氟-3-[2-(反式-4-正丙基环己基)乙烯基]苯73.8 g(0.3 mol), 200 mL无水乙醇及2.2 g含量为5%的Pd/C, 常温常压下催化加氢反应8 h。 滤去催化剂, 滤液减压浓缩至干, 得无色透明液体69.3 g, 收率93.1%, 气相色谱分析其含量为96.5%。 MSm/z(RI, %):248(M+, 8), 110(100)。
1.2.4 芳基硼酸9b的制备 与文献[1]的方法相同, 分离收率为55%。
1.2.5 缩醛11b的制备 N2气保护下, 在500 mL反应瓶中依次加入25.7 g(0.10 mol)化合物10、29.2 g(0.10 mol)芳基硼酸9b、乙醇100 mL、甲苯100 mL、水100 mL, 41.4 g(0.30 mol)碳酸钾、3.2 g(0.01 mol)四丁基溴化铵、1.16 g(1mmol)Pd(PPh3)4, 回流反应8 h。 分出有机层, 水层用甲苯500 mL萃取1次, 合并有机相旋蒸去除溶剂, 用无水乙醇重结晶得到白色晶体36.5 g, 收率86%, 气相色谱分析其含量为99.5%。 MS m/z(RI, %):424(M+, 30), 362(56), 100(100), 73(69)。
1.2.6 醛12b的制备 醛12b由文献[1]相同的方法制得, 收率95%, 气相色谱分析其含量为99.8%。
1.2.7 目标化合物1b的制备 与文献[1]相同的方法制得1b, 收率82%, 气相色谱分析其含量为99.9%。 1H NMR(CDCl3, 500 MHz), δ :0.85~0.96(m, 7H), 1.13~1.16(m, 4H), 1.27~1.32(m, 2H), 1.48~1.53(m, 2H), 1.72~1.76(m, 4H), 2.39~2.42(m, 2H), 2.61~2.66(m, 2H), 2.72~2.77(m, 2H), 4.98~5.10(t, J=20.9 Hz, J=14.2 Hz, 2H), 5.82~5.91(m, 1H), 6.93~7.01(m, 2H), 7.23~7.34(m, 3H), 7.44~7.47(d, J=7.8 Hz, 2H); MS m/z(RI, %):378(M+, 28), 337(100), 98(36)。 1H NMR与MS数据与文献[1]报道一致。
同样的方法分别合成出化合物1a, 总收率32%, 气相色谱分析其含量为99.9%; 化合物1c, 总收率29%, 气相色谱分析其含量为99.8%。
文献[1]中采用的方法, 即使采用100%纯反式的4-烷基环己烷甲酸为原料, 经过多步反应后也会产生大量不需要的顺式异构体, 这可能来源于羰基与其烯醇式之间的互变异构(Scheme 3)。
中间体7a~7c羰基与环己烷相连, 在酸或碱催化下, 易于发生烯醇互变; 反应达到平衡后, 最终产物是一定比例的顺-反式异构体混合物。 在接下来的黄鸣龙还原过程中, 在高温及强碱性条件下, 苯环上通常很难以发生反应的氟原子, 也易于进行亲核取代[4], 这是导致收率降低的原因。
针对以上分子骨架构建过程中的问题, 在路线设计方面我们采取了避开酮中间体7a~7c的方案, 采用Wittig-Horner反应建立起分子骨架, 来解决顺反异构化和脱氟副反应的问题。 实验结果表明环己烷中间体的异构现象也显著减少, 合成过程中仅出现微量的环己烷顺式异构产物, 气相色谱分析含量≤ 3%。 虽然反式4-烷基环己烷甲醛在碱性条件下也易于发生环的异构化, 但是我们在反应过程中采取滴加醛的方式, 生成 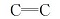
反应得到的具有乙烯基中间体16b, 是E式与Z式乙烯基异构体的混合物, 其中E和Z含量比约为80∶ 20, 以E式为主。 对于不同烷基的反应物, 反应产物的E∶ Z比例基本不变。 反应产物不经分离, 直接进行催化氢化, E、Z式异构体均转化为含有乙撑基的目标中间体17b。 由于反应是在常温常压下进行, 反应条件温和, 气相色谱分析未发现有脱氟副产物。 采用这种方法, 中间体9b以醛计算收率达到44%, 较文献[1]收率11.7%(以酸计算)大幅度提高。
在中间体11b的Suzuki偶联反应过程中, 采用Pd(PPh3)4作为催化剂, 与文献[1]中Pd/C非均相催化剂相比, 反应分离收率由62%提升到86%。 我们认为, 均相催化剂有利于提高主反应速度, 从而抑制副反应。 反应路线优化后, 目标化合物总收率达到30%左右, 较文献[1]4.5%的总收率有大幅度提高, 产物易于提纯, 色谱纯度可以达到99.8%~99.9%, 可满足液晶显示应用的需要。
为评价新合成出的液晶化合物物理性能, 将化合物1b分别与母体混合液晶配方(Host)按照的质量比20∶ 80加热混合均匀后, 测试混合液晶清亮点; 用阿贝折光仪在25 ℃, 589 nm条件下, 分别测试寻常光(no)和非寻常光(ne)的折光率, 双折射率Δ n=ne-no; 将液晶灌入10 μ m反平行测试盒中, 测试其介电各向异性值Δ ε (1 kHz, 25 ℃)和展区、弯曲弹性常数值(K11、K33)和旋转粘度(γ 1)。 混合液晶母体配方由反式-4-乙基双环己基-3, 4-二氟苯、反式-4-丙基双环己基-3, 4-二氟苯、反式-4-戊基双环己基-3, 4-二氟苯3种液晶化合物按照质量比1∶ 1∶ 1配成。
| 表1 目标化合物的物理性能测试 Table 1 Physical properties of compound 1b |
由于单体液晶的物理性能具有近似线性加和规律, 因此可以按照式(1)外推得到单体液晶的物理性能参数(X=Tcl, Δ ε , Δ n, K11, K33):
添加新型丁烯液晶的配方较Host清亮点提高3 ℃, 外推得虚拟清亮点为127.7 ℃, 由此可见该单体有利于拓展液晶温度区间。 分子中仅含有1个侧向取代氟原子, 因此极性较小, 导致配方Δ ε 下降。 配方的Δ n值显著上升, 外推得到单体液晶Δ n为0.160, 这是由于分子中两个苯环共轭, 增加了π 电子密度, 整体极化率提高所致。
添加液晶后的配方展曲弹性常数(K11)与母体液晶Host相比呈现的增大趋势, 增加约18.6%, 外推得单体K11为19.7。 显示中使用的常规液晶化合物的K11值一般在10左右, 因此这类丁烯液晶分子具有非常大的展曲弹性常数。 对于弯曲弹性常数K33, 添加后与Host相比出现下降趋势。 添加液晶后旋转粘度γ 1呈现增大趋势, 外推得单体γ 1为221.5 mPa· s。 对于决定液晶响应时间的粘弹比值γ 1/K11有所下降, 这意味能获得快速响应。
将混合液晶分别灌入5 μ m 90° 扭曲TN测试盒中, 25 ℃下测试其阈值电压(Vth)、饱和电压(Vsat)。 施加5 V方波驱动电压测试上升响应时间(ton)和下降响应时间(toff), 结果见表2。
| 表2 目标化合物的光电性能测试 Table 2 The transmittence-voltage test of compound 1b |
从表2可以看出, 加入化合物1b后阈值电压、饱和电压均呈上升趋势, 这与化合物1b介电常数小的特点相一致; TN型液晶显示的上升及下降响应时间近似由式(2)、式(3)决定[5], 据此可知上升时间增加1.64 ms, 下降时间缩短5.72 ms, 总响应时间缩短4.08 ms, 响应速度提升约10%。
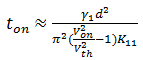 |
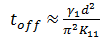 |
为了提高响应速度, 通常的做法是尽可能采用低旋转粘度的液晶材料[6], 而对液晶分子弹性常数的有效调控却报道较少, 直到最近才引起人们的关注[7]。 通过合成出具有大K11的液晶化合物1b, 同样可以有效降低液晶材料的粘弹常数比(γ 1/K11), 从而实现缩短响应时间的目的, 这给我们设计开发高性能单体液晶和混合液晶提供了新的思路。
通过采用新的方法对关键中间体合成进行改进, 并对合成路线进行优化, 总收率得到大幅提高, 具备实际应用价值。 物理性能测试表明, 该类化合物具有清亮点较高、展曲常数K11值大、粘弹系数小的优点。 光电测试表明, 该类化合物能够显著缩短液晶响应时间, 与该类化合物粘弹系数小的特点相吻合。 目前中高端液晶材料基本由国外少数几家企业所垄断, 由于专利的限制导致我国自主知识产权液晶材料发展缓慢, 仍以模仿为主。 新型丁烯液晶材料为我国突破国外专利封锁, 开发自主知识产权的混合液晶提供了新的选择。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|