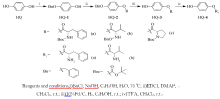
以新药设计原理中的拼合原理为指导,将对苯二酚一侧酚羟基与具有生物活性的氨基酸进行偶联,以期得到活性更好、毒性更低的对苯二酚氨基酸缀合物。 将对苯二酚的一侧酚羟基进行保护得到对苄氧基苯酚,将氨基被保护的氨基酸与其酚羟基进行偶联,去掉保护基后得到8种对苯二酚的氨基酸缀合物。 在对苄氧基苯酚的酚羟基上引入乙酸连接片段,与氨基酸甲酯盐酸盐进行偶联,去掉保护基后得到8种对苯二酚的氨基酸缀合物。 通过IR、1H NMR、13C NMR和ESI-MS等技术手段对所合成的16种氨基酸缀合物进行了结构表征。 对目标产物进行了美白活性研究。 结果表明,化合物HQ-3b、HQ-3c、HQ-4a、HQ-4b、HQ-7c和HQ-8a对酪氨酸酶的抑制作用优于阳性对照物 α-熊果苷(IC50=3.60),其中HQ-4b的IC50值低至0.15,有望成为新型化妆品美白剂。
Based on the piecing together principle in the drug design, we directly couple the hydroxyl group of lead compounds with bioactive compounds in order to get hydroquinone derivatives with high efficiency and low toxicity. 4-(Benzyloxy)phenol was synthesized through the protection of phenolic hydroxyl group, and then coupled with amino acid whose amino group was protected. Moreover, we introduced carboxylic acid moeity into 4-(benzyloxy)phenol and coupled it with amino acid methyl ester hydrochloride. After the removal of the benzyl protecting group, sixteen amino acid-hydroquinone conjugates were synthesized. The sixteen conjugates were characterized by IR,1H NMR,13C NMR and ESI-MS. The study of whitening activity of these conjugates showed that HQ-3b, HQ-3c, HQ-4a, HQ-4b, HQ-7c and HQ-8a had significant inhibition to tyrosinase(IC50=3.60) with the IC50 of HQ-4b as low as 0.15.
对苯二酚在19世纪20年代首次用蒸馏法从奎宁酸中制得, 它既应用于化妆品中的美白剂, 还应用于抗氧剂、黑白显影剂、偶氮染料、橡胶防老剂和稳定剂。 对苯二酚治疗色素性疾病的药理作用是阻断酪氨酸酶催化酪氨酸转变成二羟基苯丙酸的过程, 从而控制黑色素的生物合成, 但对苯二酚化学性质活泼易氧化变色, 具有刺激性, 会引起刺激性皮炎以及色素沉淀[1, 2], 很多国家已经把对苯二酚列入化妆品禁用品, 限制了对苯二酚类药物的临床应用和开发。 因此, 寻找一类美白活性好且对皮肤无刺激、无毒性的美白剂成为我们当今社会研究的一个热点问题。
氨基酸作为蛋白质的基本结构单元, 在人体中起着至关重要的作用, 近年来受到人们的普遍关注。 苯丙氨酸(Phenylalanine)是目前国际市场上的主导甜味剂— 阿斯巴甜的主要原料, 苯丙氨酸可以直接用于合成医药和医用复合氨基酸输液, 还可用来配制医药的培养介质, 用苯丙氨酸合成的医药有凝乳酶、HIV蛋白酶抑制剂、脑神经传递素、抗肿瘤药物对氟苯丙氨酸等[3]; 缬氨酸(Valine)属于支链氨基酸, 大量对支链氨基酸的研究表明缬氨酸是很好的强化营养剂, 可用于治疗营养不良症[4]; 脯氨酸(Proline)是植物体内重要的渗透调节物质, 植物在干旱或者温度较高的条件下会在体内积累大量的脯氨酸, 积累的脯氨酸会在植物细胞内起着渗透调节和稳定细胞结构的作用[5], 脯氨酸在提高作物抗逆性、改善作物品质方面的作用日益受到人们的关注[6]。
熊果苷(α -Arbutin)可以从多种属植物中分离得到, 是一种天然活性物质[7, 8]。 研究人员发现:熊果苷作为酪氨酸酶的抑制剂, 能阻断酪氨酸合成多巴以及多巴醌, 从而有效地抑制黑色素的生成, 具有美白作用且对皮肤没有刺激性, 毒副作用小[9]。 熊果苷有美白、活肤、祛斑、除皱等功效, 主要应用于美白化妆品中[10], 是目前化妆品领域中应用最广泛的化合物之一, 国内外市场需求十分巨大。 熊果苷一经问世, 即受到化妆品科技领先的日本、美国的格外重视和广泛利用。 日本资生堂株式会社首先推出了“ 熊果苷化妆品系列” , 美国CTFA则将其以“ Arbutus extract” 之名载入美国化妆品组分汇编。 熊果苷的结构特点是葡萄糖与对苯二酚一侧酚羟基偶联, 同样, 考虑到将葡萄糖替换成具有抗氧化活性的氨基酸, 得到类似于熊果苷结构的对苯二酚氨基酸缀合物, 并对目标产物进行酪氨酸酶的半数抑制浓度测试, 以期得到具有美白作用且对皮肤没有刺激性、毒副作用小的美白化妆品原料, 合成路线如图1所示。
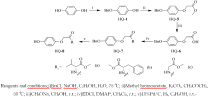 | 图2 引入乙酸连接片段的对苯二酚的氨基酸缀合物的合成Fig.2 Synthesis route of amino acid-hydroquinone conjugates through a carboxylic acid linkage |
WGH-30型双光束红外分光光度计(上海勇规分析仪器有限公司), KBr压片; BRUKER-500M Hz型核磁共振仪(瑞士Bruker公司), CDCl3、DMSO-d6为溶剂; SHIMADZU LCMS-2010EV型质谱仪(日本岛津公司); X-5型显微熔点测定仪(控温型)(北京泰克仪器有限公司), 温度未经校正; Multiskan Ascent型酶标仪(美国Thermo Fisher Scientific公司)。 所用的试剂均为国产分析纯或化学纯。
HQ-1:向100 mL三口瓶中加入C2H5OH(20 mL)和H2O(10 mL), 缓慢加入NaOH(2.0 g, 50 mmol), 搅拌至溶解, 加热至75 ℃, 加入对苯二酚(5.5 g, 50 mmol), 搅拌10 min。 在25 min内滴加氯化苄(4.43 g, 35 mmol), 滴加完后保持温度在75 ℃, 继续反应1h, TLC分析有二苄氧基取代物产生时, 停止反应。 将反应液转移到单口瓶中, 减压将溶剂蒸出, 冷却至室温, 加入1 mL 6 mol/L HCl酸化, 此时大量固体析出, 抽滤, 将滤饼转入5 mL 1.5 mol/L NaOH溶液中, 搅拌30 min, 抽滤, 转移滤液至100 mL烧瓶中, 滴加0.9 mL浓盐酸酸化, 抽滤析出的固体, 滤饼用蒸馏水洗涤至中性, 干燥, 经洗脱剂为乙酸乙酯/石油醚(体积比1∶ 3) 进行柱层析, 得乳白色至浅灰棕色粉末HQ-1:对苄氧基苯酚。然后用NaOH溶液中和滤液至中性, 回收未反应完的原料对苯二酚。 产量3.53 g, 产率35.3%, 熔点 118.5~119.7 ℃(与文献[11]值一致)。
HQ-2a:将HQ-1(200 mg, 1.0 mmol)、Boc-Phe-OH(318.4 mg, 1.2 mmol)和DMAP(244.3 mg, 2.0 mmol)用CH2Cl2(5 mL) 溶解, 将反应液冷却到0 ℃, 将EDCI(383.4 mg, 2.0 mmol)的CH2Cl2(5 mL)溶液逐滴加入, 滴加完毕在0 ℃下搅拌5 min, 然后在室温下搅拌3 h, 反应完毕减压蒸馏除去溶剂, 再用CH2Cl2/H2O萃取, 用饱和氯化钠溶液洗涤, 无水硫酸镁干燥, 过滤, 除去溶剂, 经洗脱剂为乙酸乙酯/石油醚(体积比1∶ 7) 进行柱层析, 得到白色固体HQ-2a:O-苄基-O'-(N-叔丁氧基羰基-L-苯丙氨酰基)对苯二酚。 产量337.0 mg, 产率75.3%, 熔点96.2~97.7 ℃; IR(KBr), σ /cm-1: 3376(ν N— H); 3034(ν =C— H); 2982, 2875(ν C— H); 1767, 1695(ν C=O); 1604, 1508, 1451(ν C=C); 1388(δ C— H); 1243(ν C— O— C); 855(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :1.37(s, 9H, — C(CH3)3), 3.15(d, J=5.7 Hz, 2H, — CHCH2Ph), 4.73(brs, 1H, — CHNH— ), 4.97(s, 2H, PhCH2O— ), 6.826.88(m, 4H, HQ— H), 7.16~7.27(m, 10H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :28.33, 38.45, 54.63, 70.48, 80.16, 115.52, 122.09, 127.24, 127.46, 128.06, 128.63, 128.70, 129.50, 135.84, 136.81, 144.08, 155.14, 156.68, 170.88; ESI-MS:m/z 469.9[M+Na]+。
HQ-2b:按照HQ-2a的实验方法由HQ-1(200 mg, 1.0 mmol)和Boc-Val-OH(260.7 mg, 1.2 mmol)反应得白色固体HQ-2b:O-苄基-O'-(N-叔丁氧基羰基-L-缬氨酰基)对苯二酚。 产量355.9 mg, 产率89.1%, 熔点65.9~67.1 ℃; IR(KBr):3340(ν N— H); 3035(ν =C— H); 2971, 2874(ν C— H), 2875(ν C— H); 1760(ν C=O); 1691(δ N— H); 1596, 1526, 1504, 1461(ν C=C); 1366(δ C— H); 1243(ν C— O— C); 849(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :1.01(d, J=2.8 Hz, 3H, — CH3), 1.07(d, J=6.8 Hz, 3H, — CH3), 1.47(s, 9H, — C(CH3)3), 2.292.32(m, 1H, — CH(CH3)2), 4.45(dd, J1=8.8 Hz, J2=4.4 Hz, 1H, — NHCH— ), 5.05(s, 2H, PhCH2O— ), 5.07(d, J=9.2 Hz, 1H, — NH— ), 6.957.02(m, 4H, HQ— H), 7.337.44(m, 5H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :17.71, 19.09, 28.35, 31.44, 58.70, 70.49, 79.97, 115.57, 122.17, 127.46, 128.05, 128.63, 136.81, 144.17, 155.73, 156.67, 171.40; ESI-MS:m/z 421.9[M+Na]+。
HQ-2c:按照HQ-2a的实验方法由HQ-1(200 mg, 1.0 mmol)和Boc-Pro-OH(258.3 mg, 1.2 mmol)反应得到白色固体HQ-2c:O-苄基-O'-(N-叔丁氧基羰基-L-脯氨酰基)对苯二酚。 产量353.5 mg, 产率88.9%, 熔点111.5112.9 ℃; IR(KBr), σ /cm-1:3086(ν =C— H); 2961, 2879(ν C— H); 1773, 1722(ν C=O); 1610, 1597, 1507, 1478(ν C=C); 1350(δ C— H); 1243(ν C— O— C); 866(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :1.46(s, 9H, — C(CH3)3), 1.902.40(m, 4H, — CH2CH2— ), 3.433.65(m, 2H, — NCH2), 4.144.52(m, 1H, — COCHN— ), 5.05(s, 2H, PhCH2O— ), 6.937.04(m, 4H, HQ— H), 7.257.43(m, 5H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :23.70, 28.46, 31.07, 46.46, 59.19, 70.50, 80.18, 115.56, 121.93, 127.46, 128.05, 128.62, 136.82, 144.35, 153.78, 156.56, 171.91; ESI-MS:m/z 419.9[M+Na]+。
HQ-3a:将HQ-2a(300 mg, 0.67 mmol)溶于无水乙醇(10 mL)中, 在搅拌下加入10%Pd/C(45 mg), 在H2气氛围中搅拌7 h, 过滤除去不溶物, 滤液在减压蒸馏下得到粗品, 经洗脱剂为乙酸乙酯/石油醚(体积比1∶ 5)进行柱层析, 得白色固体HQ-3a:O-(N-叔丁氧基羰基-L-苯丙氨酰基)对苯二酚。 产量133.6 mg, 产率55.8%, 熔点130.6131.9 ℃; IR(KBr), σ /cm-1:3425(ν OH); 3380(ν N— H); 3034(ν =C— H); 2990, 2857(ν C— H); 1729(ν C=O); 1678(δ N— H), 1599, 1527, 1508(vC=C); 1367(δ C— H); 859(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :1.45(s, 9H, — C(CH3)3), 3.23(d, J=6.1 Hz, 2H, PhCH2— ), 4.79(dd, J1=13.9 Hz, J2=6.3 Hz, 1H, — CHNH— ), 5.08(d, J=7.8 Hz, 1H, — NH— ), 5.42(s, 1H, — OH), 6.776.84 (m, 4H, HQ— H), 7.237.36 (m, 5H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :28.34, 38.37, 54.65, 80.40, 116.03, 122.17, 127.29, 128.74, 129.48, 135.75, 143.74, 153.80, 155.32, 171.04; ESI-MS:m/z 379.9[M+Na]+。
HQ-3b:按照HQ-3a的实验方法由HQ-2b(300 mg, 0.75 mmol)和10%Pd/C(45 mg)反应得白色固体HQ-3b:O-(N-叔丁氧基羰基-L-缬氨酰基)对苯二酚。 产量164.3 mg, 产率70.8%, 熔点86.6~87.4 ℃; IR(KBr), σ /cm-1: 3494(ν OH); 3381(ν N— H); 3079(ν =C— H); 2981, 2872(ν C— H); 1744(ν C=O); 1682(δ N— H); 1612, 1516, 1442(ν C=C); 1393(δ C— H); 1194(ν C— O); 826(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :1.01(d, J=6.9 Hz, 3H, — CH3), 1.07(d, J=6.8 Hz, 3H, — CH3), 1.47(s, 9H, — C(CH3)3), 2.232.30(m, 1H, — CH(CH3)2), 4.44(dd, J1=9.0 Hz, J2=4.8 Hz, 1H, — CHNH— ), 5.10(d, J=8.9 Hz, 1H, — NH— ), 5.40(brs, 1H, — OH), 6.796.93(m, 4H, HQ— H); 13C NMR(500 MHz, CDCl3), δ :17.68, 19.07, 28.35, 31.32, 58.77, 80.38, 116.09, 122.16, 143.62, 154.03, 156.01, 171.64; ESI-MS:m/z 332.0[M+Na]+。
HQ-3c:按照HQ-3a的实验方法由HQ-2c(300 mg, 0.75 mmol)和10%Pd/C(45 mg)反应得白色固体HQ-3c:O-(N-叔丁氧基羰基-L-脯氨酰基)对苯二酚。 产量133.6 mg, 产率55.8%, 熔点167.5~168.3 ℃; IR(KBr), σ /cm-1:3440(ν OH); 3040(v=C— H); 2976, 2871(ν C— H); 1765(ν C=O); 1665(δ N— H); 1599, 1513, 1481(ν C=C); 1373(δ C— H); 1199(ν C— O); 859(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :1.41(s, 9H, — C(CH3)3), 1.842.32(m, 4H, — CH2CH2— ), 3.483.57(m, 2H, — NCH2), 4.36(dd, J1=8.7 Hz, J2=4.2 Hz, 1H, — COCHN— ), 5.55(brs, 1H, — OH), 6.676.86(m, 4H, HQ— H); 13C NMR(500 MHz, CDCl3), δ :23.67, 28.46, 31.00, 46.51, 59.29, 80.68, 116.11, 121.88, 143.69, 154.17, 154.74, 172.04; ESI-MS:m/z 329.9[M+Na]+。
HQ-4a:将HQ-3a(100 mg, 0.28 mmol)溶于CH2Cl2(5 mL)中, 冷却到0 ℃后加入TFA(0.62 mL, 8.39 mmol), 再将温度升至室温搅拌2 h, 反应结束后在冰水浴中用氨水中和至微碱性, 用CH2Cl2/H2O萃取, 合并有机相, 饱和氯化钠溶液洗涤, 无水硫酸镁干燥有机相, 过滤, 减压蒸馏得粗产物。 经洗脱剂为乙酸乙酯/石油醚(体积比2∶ 1)进行柱层析, 得白色固体HQ-4a:O-苯丙氨酰基对苯二酚。 产量59.6 mg, 产率82.8%, 熔点117.8119.1 ℃; IR(KBr), σ /cm-1:3464(ν OH); 3340, 3288(ν N— H); 3031(ν =C— H); 2953, 2813(ν C— H); 1745(ν C=O); 1598, 1516, 1469(ν C=C); 1194(ν C— O); 819(δ =C— H); 1H NMR(500 MHz, DMSO-d6), δ :2.96(dd, J1=6.8 Hz, J1=3.3 Hz, 2H, PhCH2— ), 3.78(t, J=6.9 Hz, 1H, — CHNH2), 6.556.75(m, 4H, HQ— H), 7.227.33(m, 5H, Ph— H), 9.44(s, 1H, — OH); 13C NMR(500 MHz, CDCl3), δ :41.68, 56.65, 116.83, 127.87, 129.56, 130.31, 138.28, 151.25, 176.22; ESI-MS:m/z 279.9[M+Na]+。
HQ-4b:按照HQ-4a的实验方法由HQ-3b(100 mg, 0.32 mmol)和TFA(0.72 mL, 9.70 mmol)反应得白色固体HQ-4b:O-缬氨酰基对苯二酚。 产量38.56 mg, 产率57.6%, 熔点115.0116.5 ℃; IR(KBr), σ /cm-1:3437(ν OH); 3343, 3279(ν N— H); 3075(ν =C— H); 2959, 2925(ν C— H); 1745(ν C=O); 1599, 1509, 1473(ν C=C); 1187(ν C— O); 837(δ =C— H); 1H NMR(500 MHz, DMSO-d6), δ :0.98(d, J=6.8 Hz, 3H, — CH3), 0.99(d, J=6.6 Hz, 3H, — CH3), 1.962.02(m, 1H, — CH(CH3)2), 3.31(brs, 1H, — CHNH2), 6.746.89(m, 4H, HQ— H), 9.46(s, 1H, — OH); 13C NMR(500 MHz, CDCl3), δ :17.92, 19.18, 33.36, 60.79, 116.82, 151.25, 176.57; ESI-MS:m/z 231.9[M+Na]+。
HQ-5:将HQ-1(1.0 g, 5.0 mmol)、溴乙酸甲酯(1.39 mL, 15.0 mmol)、无水碳酸钾(2.1 g, 15.0 mmol)、丙酮(10 mL)依次加入100 mL圆底烧瓶中, 在50 ℃下搅拌, 反应12 h, 反应完毕后冷却到室温, 用乙酸乙酯和水进行萃取, 有机层用无水MgSO4干燥, 过滤, 经减压蒸馏得粗产品。 经洗脱剂为乙酸乙酯/石油醚(体积比1∶ 5)进行柱层析, 得淡黄色固体HQ-5:4-苄氧基-苯氧基乙酸甲酯。 产量1.1 g, 产率81.0%, 熔点77.478.6 ℃; IR(KBr), σ /cm-1:3031(ν =C— H); 2951, 2866(ν C— H); 1773(ν C=O); 1635, 1585, 1505, 1444(ν C=C); 1246, 1215(ν C— O— C); 826(δ =C-H); 1H NMR(500, MHz, CDCl3), δ :3.80(s, 3H, — OCH3), 4.59(s, 2H, — OCH2CO— ), 5.02(s, 2H, PhCH2— ), 6.856.92(m, 4H, HQ— H), 7.267.39(m, 5H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :52.17, 66.28, 70.67, 115.91, 127.46, 127.93, 128.57, 137.18, 152.25, 153.85, 169.64; ESI-MS:m/z 294.9[M+Na]+。
HQ-6:将HQ-5(1.05 g, 3.86 mmol)溶于甲醇(10 mL)中, 加入甲醇钠(3.13 g, 57.8 mmol), 在室温下搅拌10 h, 反应完毕后, 减压蒸馏除去溶剂, 滴加1 N HCl 将pH值调至23, 用乙酸乙酯/水进行萃取, 合并有机相, 用饱和氯化钠溶液洗涤, 有机相用无水硫酸镁干燥, 过滤, 减压蒸馏得粗产物。经洗脱剂为乙酸乙酯/石油醚(体积比1∶ 2)进行柱层析, 得白色固体HQ-6:4-苄氧基-苯氧基乙酸。 产量771.6mg, 产率77.4%, 熔点100.6~101.8 ℃; IR(KBr), σ /cm-1: 3415(ν OH); 3055(ν =C— H); 2950, 2862(ν C— H); 1750(ν C=O); 1616, 1566, 1501, 1425(ν C=C); 1242(ν C— O— C); 826(δ =C— H). 1H NMR(500 MHz, DMSO-d6), δ :4.43(s, 2H, — OCH2CO— ), 5.01(s, 2H, PhCH2— ), 6.796.92(m, 4H, HQ— H), 7.287.42(m, 5H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :65.07, 69.65, 115.36, 115.62, 127.54, 127.68, 128.34, 137.29, 151.94, 152.71, 170.31; ESI-MS:m/z 280.5[M+Na]+。
HQ-7a:按照HQ-2a的实验方法由HQ-6(200.0 mg, 0.77 mmol)和H-Val-OMe· HCl(155.77 mg, 0.93 mmol)反应得白色固体HQ-7a:4-苄氧基-苯氧基-N-(1-甲氧羰基)-异丁基-乙酰胺。 产量171.6 mg, 产率60.0%, 熔点82.784.2 ℃; IR(KBr), σ /cm-1:3413(ν N— H); 3073(ν =C— H); 2963, 2866(ν C— H); 1743(ν C=O); 1674, 1536, 1514, 1464(ν C=C); 1386(δ C— H); 1239(ν C— O— C); 824(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :0.82(d, J=6.9 Hz, 3H, — CH(CH3)2), 0.86(d, J=6.9 Hz, 3H, — CH(CH3)2), 2.082.18(m, 1H, — CH(CH3)2), 3.67(s, 3H, — OCH3), 4.42(d, J=6.5 Hz, 2H, — OCH2CO— ), 4.54(dd, J1=9.1 Hz, J2=5.0 Hz, 1H, — NHCHCO— ), 4.95(s, 2H, PhCH2— ), 6.806.87(m, 4H, HQ— H), 6.95(d, J=8.7 Hz, 1H, — NH— ), 7.197.30(m, 5H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :17.72, 18.92, 31.28, 52.16, 56.65, 68.22, 70.65, 115.90, 116.07, 127.43, 127.94, 128.56, 137.04, 151.61, 154.01, 168.43, 171.92; ESI-MS:m/z 393.9[M+Na]+。
HQ-7b:按照HQ-2a的实验方法由HQ-6(200 mg, 0.77 mmol)和H-Phe-OMe· HCl(200.58 mg, 0.93 mmol)反应得白色固体HQ-7b:4-苄氧基-苯氧基-N-(1-甲氧羰基)-苯乙基-乙酰胺。 产量255.5 mg, 产率79.1%, 熔点101.5102.9 ℃; IR(KBr), σ /cm-1:3310(ν N— H); 3030(ν =C— H); 2959, 2869(ν C— H); 1754(ν C=O); 1661, 1550, 1503, 1443(ν C=C); 1225(ν C— O— C); 821(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :3.12(dd, J1=9.7 Hz, J2=2.5 Hz, 1H, PhCH2CH— ), 3.16(dd, J1=14.6 Hz, J2=6.1 Hz, 1H, PhCH2CH— ), 3.73(s, 3H, — OCH3), 4.43(d, J=6.5 Hz, 2H, — OCH2CO— ), 4.96(dt, J1=8.3 Hz, J2=6.1 Hz, 1H, — NHCHCO— ), 5.02(s, 2H, PhCH2O— ), 6.896.92(m, 4H, HQ— H), 6.99(d, J=8.0 Hz, 1H, — NH— ), 7.057.31(m, 10H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :37.96, 52.33, 52.54, 68.11, 70.63, 115.80, 116.01, 127.19, 127.41, 127.94, 128.56, 128.62, 129.18, 135.53, 137.05, 151.59, 153.95, 168.20, 171.46; ESI-MS:m/z 441.9[M+Na]+。
HQ-7c:按照HQ-2a的实验方法由HQ-6(200 mg, 0.77 mmol)和H-Gly-OMe· HCl(116.8 mg, 0.93 mmol)反应得白色固体HQ-7c:4-苄氧基-苯氧基-N-(1-甲氧羰基)-亚甲基-乙酰胺。 产量225.9 mg, 产率89.1%, 熔点87.0~88.1 ℃; IR(KBr), σ /cm-1:3314(ν N— H); 3056(ν =C— H); 2939, 2863(ν C— H); 1736(ν C=O); 1656(δ N— H); 1596, 1554, 1508, 1444(ν C=C); 1387(δ C— H); 1234(ν C— O— C); 829(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :3.78(s, 3H, — OCH3), 4.14(d, J=5.5 Hz, 2H, — NHCH2CO— ), 4.49 (s, 2H, — OCH2CO— ), 5.03(s, 2H, PhCH2— ), 6.866.94(m, 4H, HQ— H), 7.10(brs, 1H, — NH— ), 7.267.42(m, 5H, Ph— H); 13C NMR(500 MHz, CDCl3), δ :40.63, 52.35, 68.11, 70.59, 115.83, 116.01, 127.40, 127.92, 128.53, 137.01, 151.57, 153.98, 168.82, 169.84; ESI-MS:m/z 351.9[M+Na]+。
HQ-8a:按照HQ-3a的实验方法由HQ-7a(100 mg, 0.27 mmol)和10%Pd/C(15 mg)反应得白色固体HQ-8a:4-羟基-苯氧基-N-(1-甲氧羰基)-异丁基-乙酰胺。 产量65.0 mg, 产率85.7%, 熔点78.981.1 ℃; IR(KBr), σ /cm-1:3343(ν OH); 3314(ν N— H); 3040(ν =C— H); 2965, 2873(ν C— H); 1734(ν C=O); 1654(δ N— H); 1596, 1551, 1509, 1448(ν C=C); 1368(δ C— H); 1226(ν C— O— C); 825(δ =C— H); 1H NMR(500 MHz, CDCl3): δ 0.90(d, J=6.9 Hz, 3H, — CH(CH3)2), 0.94(d, J=6.9 Hz, 3H, — CH(CH3)2), 2.172.26(m, 1H, — CH(CH3)2), 3.75(s, 3H, — OCH3), 4.48(d, J=8.4 Hz, 2H, — OCH2CO— ), 4.62(dd, J1=9.1 Hz, J2=5.0 Hz, 1H, — NHCHCO— ), 5.83(brs, 1H, — OH), 6.786.83(m, 4H, HQ— H), 7.10(d, J=8.6 Hz, 1 H, — NH— ); 13C NMR(500 MHz, CDCl3), δ :17.72, 18.93, 31.26, 52.30, 56.82, 68.25, 116.09, 116.33, 151.06, 151.33, 169.08, 172.01; ESI-MS:m/z 303.9[M+Na]+。
HQ-8b:按照HQ-3a的实验方法由HQ-7b(150 mg, 0.36 mmol)和10%Pd/C(22.5 mg)反应得白色固体HQ-8b:4-羟基-苯氧基-N-(1-甲氧羰基)-苯乙基-乙酰胺。 产量103.2 mg, 产率87.8%, 熔点79.881.4 ℃; IR(KBr), σ /cm-1:3366(ν OH); 3302(ν N— H); 3027(ν =C— H); 2958, 2855(ν C— H); 1746(ν C=O); 1660, 1542, 1507, 1446(ν C=C); 820(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :3.13(dd, J1=10.2 Hz, J2=2.5 Hz, 1H, PhCH2— ), 3.17(dd, J1=13.9 Hz, J2=6.1 Hz, 1H, PhCH2— ), 3.73(s, 3H, — OCH3), 4.41(d, J=4.4 Hz, 2H, — OCH2CO— ), 4.96(dt, J1=8.2 Hz, J2=6.0 Hz, 1H, — NHCHCO— ), 5.69(s, 1H, — OH), 6.706.77(m, 4H, HQ— H), 7.057.29(m, 6H, Ph— H, — NH— ); 13C NMR(500 MHz, CDCl3), δ :37.95, 52.48, 52.68, 68.14, 116.01, 116.29, 127.29, 128.71, 129.19, 135.42, 151.12, 151.19, 168.79, 171.58; ESI-MS:m/z 351.9[M+Na]+。
HQ-8c:按照HQ-3a的实验方法由HQ-7c(150 mg, 0.455 mmol)和10%Pd/C(22.5 mg)反应得油状液体HQ-8c:4-羟基-苯氧基-N-(1-甲氧羰基)-亚甲基-乙酰胺。 产量84.5 mg, 产率77.6%; IR(KBr), σ /cm-1:3469(ν OH); 3351(ν N— H); 3042(ν =C— H); 2961, 2828(ν C— H); 1730(ν C=O); 1656(δ N— H); 1596, 1553, 1479(ν C=C); 1361(δ C— H); 830(δ =C— H); 1H NMR(500 MHz, CDCl3), δ :3.78(s, 3H, — OCH3), 4.15(d, J=5.5 Hz, 2H, — NHCH2CO— ), 4.47(s, 2H, — OCH2CO— ), 5.61(brs, 1H, — OH), 6.786.82(m, 4H, HQ— H), 7.17(brs, 1H, — NH— ); 13C NMR(500 MHz, CDCl3), δ :40.74, 52.54, 68.13, 116.04, 116.32, 151.00, 151.36, 169.60, 169.99; ESI-MS:m/z 261.9[M+Na]+。
开启酶标仪, 设定酶标仪上的各项指标, 预热30 min以上。每个96孔板标记分成4区, 每3列为一区, 使用同一种药品。 向B-H行中每孔分别加入40 μ L的一定浓度的DMSO溶液。向A、B行中, 加入40 μ L的合成的抑制剂, 每3列为一区, 使用同一种药品。 从B行开始, 分别从每孔中取出40 μ L溶液加入同列的下一孔中, 直至G行。 G行中每孔取出的40 μ L溶液直接弃用, 这过程中抑制剂逐级二倍稀释。 96孔板上每孔中依次加入80 μ L 0.067 mol/L PPB, 40 μ L 2.5 g/L底物溶液。 然后将96孔板移至预热好并设定好的酶标仪前, 每孔中加入40 μ L 96 U/mL酪氨酸酶溶液, 迅速放入酶标仪中测定不同时间段492 nm吸光值。 各孔加入溶液终体积为200 μ L, 包括终浓度为0.5 g/L底物(酪氨酸)溶液、19.2 U/mL酶溶液以及各浓度梯度的抑制剂。 代替抑制剂, 加入使用相应浓度的DMSO作为阴性对照, 记录并分析实验数据, 平行实验重复3次。
通过对所合成的目标化合物进行酪氨酸酶抑制效果测试, 得到化合物在不同浓度范围内对酪氨酸酶的半数抑制浓度。 根据测试结果, 总结16个对苯二酚氨基酸缀合物对酪氨酸酶的抑制效果, 如表1所示。
| 表1 对苯二酚的氨基酸缀合物对酪氨酸酶的半数抑制浓度对照 Table 1 The IC50 of the amino acids conjugates of hydroquinone on tyrosinase |
从表1可以看出, HQ-3b、HQ-3c、HQ-4a、HQ-4b、HQ-7c和HQ-8a对酪氨酸酶的抑制作用优于阳性对照物α -Arbutin, 其中HQ-4b最明显。 因此, HQ-3b、HQ-3c、HQ-4a、HQ-4b、HQ-7c和HQ-8a具有较好的美白活性。
对具有美白活性的化合物进行构效关系分析, 初步得到以下结论:1)对苯二酚一侧酚羟基与氨基酸进行偶联后, 去掉另一侧酚羟基的保护基, 使得结构中必须含有一个酚羟基时, 化合物才显示出美白活性; 2)对苯二酚一侧酚羟基直接与氨基酸进行偶联的缀合物的活性优于引入乙酸连接片段的对苯二酚的氨基酸缀合物的活性; 3)脂肪族氨基酸缀合物的活性优于芳香族氨基酸缀合物的活性。
对所合成的16种新化合物进行酪氨酸酶抑制活性的研究, 是对其美白活性的初筛, 其具体的美白作用机制及细胞活性, 需要进行后续的实验和深入的研究。
本文以对苯二酚为起始原料, 在碱性条件下、C2H5OH和H2O的混合溶剂中, 与BnCl反应得到单侧酚羟基保护的产物。 其中一条路线是直接与一系列氨基被保护的氨基酸进行偶联, 在10%钯碳条件下脱去苄基保护基, 最后在三氟乙酸条件下脱去Boc保护基。 另外一条路线是在对苯二酚单侧羟基进行苄基保护后引入乙酸连接片段, 再与一系列氨基酸甲酯盐酸盐进行偶联, 最后在10%钯碳条件下脱去苄基保护基, 共设计合成了16种未见报道的对苯二酚氨基酸缀合物。 利用IR、1H NMR和ESI-MS波谱技术对其结构进行了表征, 并对目标产物进行了酪氨酸酶抑制作用测试。 结果表明, 化合物HQ-3b、HQ-3c、HQ-4a、HQ-4b、HQ-7c和HQ-8a对酪氨酸酶的抑制作用优于阳性对照物α -Arbutin, 其中HQ-4b最明显, 以上6种化合物可作为潜在的美白剂应用于化妆品市场。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|